Навигация
Хлористый водород — бесцветный газ с резким запахом и вкусом
1. Хлористый водород — бесцветный газ с резким запахом и вкусом.
2. Плотность газа относительно кислорода равна 1,1471, что соответствует молекулярному весу 36,71, в то время как рассчитанный по формуле НС1 молекулярный вес оказывается равным 36,47. Следовательно, хлористый водород при обычной температуре состоит из простых молекул HС1. Его можно достаточно легко перевести в жидкое состояние. Даже вблизи температуры сжижения плотность газа все еще близка к нормальной.
3. Хлористый водород жадно поглощается водой в больших количествах и с сильным выделением тепла. При атмосферном давлении 1 об. воды при комнатной температуре может растворить около 450 об. хлористого водорода.
4. При сильном охлаждении в зависимости от состава раствора из растворов кристаллизуются различные гидраты: НС1·ЗН2О (т. пл. —24,9°), НС1·2Н2О (т. пл. —17,6°) и НС1·Н2О (т. пл. —15,3°). Правда, из раствора, насыщенного при 0° хлористым водородом под давлением 1 атм, может выделиться только тригидрат (с содержанием 40,3% НС1). Остальные гидраты выделяются из растворов, насыщенных хлористым водородом под давлением выше атмосферного. Раствор, насыщенный хлористым водородом при атмосферном давлении, при 0° содержит 45,4 вес.% НС1, а при 15° — 42,7 вес.%. Если такой раствор нагреть, то сначала выделяется хлористый водород, а затем при температуре около 110° перегоняется смесь постоянного состава с содержанием хлористого водорода 20,24%. Смесь того же состава можно получить, если исходить из более разбавленных растворов. Однако состав смеси, кипящей при постоянной температуре, зависит от давления, при котором производится перегонка.
5. Водные растворы хлористого водорода обычно называют соляной кислотой. Содержание в ней хлористого водорода устанавливают чаще всего посредством ареометра.
Соляная кислота плотностью 1,060 1,124 1,16 1,19
при 15° содержит, 12,2 24,8 31,5 37,2% НС1
6. Помимо воды, хлористый водород сильно растворим также в спирте, в эфире и еще во многих других жидкостях. Наоборот, жидкий хлористый водород может служить растворителем для спирта, эфира и многих других веществ.
7. На большинство металлов жидкий хлористый водород не действует, он не реагирует в общем также с оксидами, сульфидами и карбонатами. Газообразный хлористый водород при температуре каления реагирует с выделением водорода с металлами, причем даже с такими металлами, на которые водная соляная кислота без доступа воздуха не действует, например с медью и серебром. (Водный раствор HCl взаимодействует только с металлами, стоящими в ряду СЭП до водорода)
Сu + 2HCl = CuCl2 + H2↑
CuCl2 + 2HCl = H2[CuCl4],
2Ag + 4HCl = 2H[AgCl2] + H2↑
8. C фтором хлористый водород взаимодействует уже при обычной температуре с образованием пламени, с кислородом воздуха он реагирует только в присутствии катализаторов:
2HCl + F2 = Cl2↑ + 2HF,
4HCl + O2![]() 2H2O + 2Cl2↑.
2H2O + 2Cl2↑.
9. В водном растворе HCl полностью диссоциирована на ионы, поэтому соляную кислоту относят к сильным кислотам.
HCl↔ H+ + Cl-
10. Соляная кислота взаимодействует с основными оксидами:
2HCl + MgO = MgCl2+ H2O
Так же она способна при взаимодействии с сильными окислителями проявлять восстановительные свойства:
4HCl + MnO2 = MnCl2 + Cl2↑+2H2O
Физико - химическая характеристика NO2
1. Бурый газ. Выше 135° С — мономер, при комнатной температуре — красно-бурая смесь NO2 и его димера (тетраоксида диазота) N2O4. В жидком состоянии димер бесцветен, в твердом состоянии белый. Хорошо растворяется в холодной воде (насыщенный раствор — ярко-зеленый), полностью реагирует с ней. Реагирует со щелочами:
2NaOH + 2NO2 = NaNO2 + NaNO3 + H2O.
3NO2 + H2O(горяч) = 2HNO3 + NO↑,
2NO2 + H2O(холод) = HNO3 + HNO2.
2. Очень сильный окислитель. Вызывает коррозию металлов.
3. Плотность 2,0527 г/л.
4. Температура плавления тетраоксида азота -11,2°С, растворимость в воде при 0°С – 1,491г.
|
|
5. При температуре от -11,2°С до +20,7°С находится в равновесии:
|
|
6. В интервале температур выше 135 °С и до температуры равной 620°С оксид азота (IV) распадается с образованием кислорода и оксида азота (II):
|
|
7. При растворении в воде в присутствии кислорода воздуха окисляется до азотной кислоты:
Физико – химическая характеристика воды:
1. Чистая вода не имеет ни запаха, ни вкуса и бесцветна, однако в толстом слое она имеет голубоватый цвет. При достаточно сильном охлаждении она замерзает, превращаясь в лед. Температура, при которой лед и вода образуют при нормальном давлении (760 мм рт. ст.) устойчивую систему, принята за нулевую точку шкалы термометра Цельсия. Температура 100° определяется точкой кипения воды при нормальном давлении.
2. Температура кипения воды сильно зависит от давления, так при 760 мм рт. ст она равна 100°, при увеличении давления температура кипения воды возрастает. При росте давления на 1 мм. рт. ст. температура кипения возрастает на 0,3—0,4°.
3. Физические константы воды:
- температура замерзания воды (точка тройного равновесия) —0° (н.у.);
- температура кипения —100° (н.у.);
- плотность льда при 0° равна 0,9168 г/см3;
- плотность воды при 4° равна 1 г/см3, при повышении или понижении температуры, плотность воды уменьшается.
4. При температуре около 1000° вода термически распадается на простые вещества:
2H2O 2H2↑ + O2↑,
а при действии радиоактивного излучения при высоких температурах наблюдается распад воды по схеме:
H2O®H0, H2, O0, O2, OH0, H2O2, HO20.
Физико – химическая характеристика О2
1. Кислород – при обычных условиях газ без цвета и запаха, в толстых слоях – голубой.
2. Плотность жидкого кислорода 1,429 г/см3.
3. Температура плавления -218,8°С.
4. Температура кипения -183,0 °С.
5. Сильный окислитель, особенно атомарный кислород (в момент выделения).
Получение MgO:
На аналитических весах взять навеску шестиводного кристаллогидрата нитрата магния (Mg(NO3)2 · 6H2O) массой 13,5 г и поместить в фарфоровый тигель. Тигель поставить в муфельную печь, нагретую до 400 – 450° С. Прокаливать до тех пор, пока не прекратится выделение оксида азота (IV) бурого цвета.
2Mg(NO3)2 ![]() 2MgO + 4NO2↑+O2↑
2MgO + 4NO2↑+O2↑
Взвесить полученный оксид и рассчитать выход продукта по следующей формуле:
![]() , масса теоретическая равна 2,11г.
, масса теоретическая равна 2,11г.
Получение MgCl2.
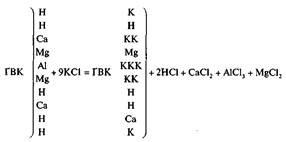
К полученному оксиду магния прилить 9,37 мл соляной кислоты (r = 1,174 г/мл) до полного его растворения. Полученный раствор упаривают до появления корки кристаллов на поверхности. Дальнейшее нагревание ведут осторожно, не допуская перегрева смеси выше 200° С. При перегреве хлорида магния выше этой температуры возможно его частичное разложение с образованием оксохлорида магния (Mg2OCI2).
MgO + 2HCl = MgCl2 + H2O
2MgCl2 + H2O = Mg2OCI2 + 2HCl
(полностью воду хлорид магния теряет при температуре 505° С с разложением, при 200° С. существует его кристаллогидрат MgCl2×H2O)
Качественный анализ ионов магния (Mg2+).
1. Гидроксиды КОН и NaOH образуют с катионом Mg2+ белый аморфный осадок гидроксида магния Mg(OH)2, растворимого в кислотах и солях аммония.
Опыт. В первую пробирку возьмите 4 капли раствора соли магния, прибавьте 4 капли насыщенного раствора хлорида аммония NH4C1.
Во вторую пробирку возьмите 4 капли раствора соли магния и прибавьте 4 капли воды (чтобы концентрация растворов была одинаковая).
Затем в обе пробирки прибавьте осадитель — гидроксид аммония NH4OH. В первой пробирке осадок не вападает так как образуется комплексное соединение.
2. Гидрофосфат натрия Na2HPO4 дает с катионом Mg2+в присутствии гидроксида и хлорида аммония NH4OH и NH4C1 белый кристаллический осадок фосфата магния-аммония MgNH4PO4:
MgSO4 + Na2HPO4 + NH4OH ® MgNH4PO4¯ + Na2SO4 + H2O
Mg2+ + НРО2- + NH4OH®MgNH4PO4¯ + HaO
Хлорид аммония добавляют, чтобы не выпал аморфный осадок гидроксида магния Mg(OH) 2.
Опыт. Возьмите 3—4 капли раствора соли магния и смешайте с 4—6 каплями 2 н. раствора хлороводородной кислоты и 3—5 каплями раствора гидрофосфата натрия Na2HPO4. После этого прибавьте к раствору по одной капле 2 н. раствора аммиака, перемешивая раствор после каждой капли. Вначале аммиак нейтрализует прибавленную кислоту, причем образуется хлорид аммония NH4C1, препятствующий образованию гидроксида магния Mg(OH)2. После окончания реакции выпадает характерный кристаллический осадок—фосфат магния-аммония MgNH4PO4.
1. Реакция проводится в аммиачной среде при рН 8.
2. Избыток катионов NH4+ мешает выпадению осадка MgNH4PO4.
3.Не следует брать избыток хлороводородной кислоты.
3. Магнезон I (napa-нитробензолазорезорцин) или магнезон II (пара-нитробензолазо-a-нафтол) в щелочной среде дает красную или красно-фиолетовую окраску. Эта реакция основана на свойстве гидроксида магния адсорбировать некоторые красители.
Опыт. На фарфоровую пластинку (предметное стекло) поместите 1—2 капли анализируемого на катион Mg2+ раствора и добавьте 1—2 капли щелочного раствора реактива. Появляется синяя окраска или синий осадок. Если раствор имеет сильнокислую реакцию, то появляется желтая окраска. В данном случае к раствору надо добавить несколько капель щелочи.
Условия проведения опыта.
1.Реакцию необходимо проводить в щелочной среде при рН>10.
2.Реакции мешает наличие солей аммония.
Количественный анализ ионов магния (Mg2+).
Из полученного хлорида магния приготовить 100 мл 0,1н. раствора (растворить 0,0476 г MgCl2 в 100 мл воды). Отдельно готовят 250 мл 0,1 н. раствора этилендиаминтетраацетата натрия (трилона Б) (4,65 г в 250 мл воды), и 0,1 н. раствор сульфата магния ( 1,23 г MgSO4×7H2O в 100 мл воды). Устанавливают титр трилона Б по сульфату магния. Для этого отбирают аликвоту сульфата магния (25 мл), прибавляют 50 мл воды, 25 мл аммиачной буферной смеси (100 мл 20-процентного раствора хлорида аммония и 100 мл 20-процентного раствора аммиака доводят водой до одного литра), 20-30 мг сухой смеси индикатора хромогена черного с хлоридом натрия и титруют из бюретки приготовленным раствором трилона Б до перехода красной окраски в синюю. Так поступают 3 раза, по среднему значению высчитывают нормальную концентрацию трилона Б по формуле Сн1*V1=Cн2*V2.
Установив титр трилона Б по сульфату магния, приступают к определению концентрации приготовленного раствора хлорида магния. По выше приведенной формуле рассчитывают нормальную концентрацию хлорида магния. И по формуле mx=Сн*V(р)*Mэ (в 100 мл воды) рассчитывают истинную массу хлорида магния в полученном в ходе синтеза соединении. Процентное содержание MgCl2 находят по формуле h=mx/0,0476.
Качественный анализ ионов хлора Сl-.
1. Нитрат серебра AgNO3 образует с анионом С1- белый творожистый осадок хлорида серебра, нерастворимый в воде и кислотах. Осадок растворяется в аммиаке, при этом образуется комплексная соль серебра [Ag(NH3)2]C1. При действии азотной кислоты комплексный ион разрушается и хлорид серебра снова выпадает в осадок. Реакции протекают в такой последовательности:
Cl- + Ag+ ®AgCl¯
AgCl + 2NH4OH ® [Ag(NH3)2]Cl + 2H2O
[Ag(NH3)2]Cl + .2H+ ® AgCl¯+ 2NH4+
Опыт. В коническую пробирку к 2—3 каплям раствора хлорида магния прибавьте 1—2 капли раствора нитрата серебра. Выпавший осадок отделите центрифугированием. К осадку добавьте раствор аммиака до полного растворения. В полученном растворе откройте хлорид-ион С1- действием 3—5 капель 2 н. раствора азотной кислоты.
2. Оксид марганца МnО2, оксид свинца РЬО2 и другие окислители при взаимодействии с анионом С1- окисляют его до свободного хлора, который легко обнаружить по запаху и. посинению бумаги, смоченной раствором иодида калия и крахмального клейстера:
2Сl- + МnО2 + 4Н+ ® Cl2↑ + Мn2+ + 2Н2О,
Сl2 + 2I- ® I2 + 2Сl-.
Похожие работы
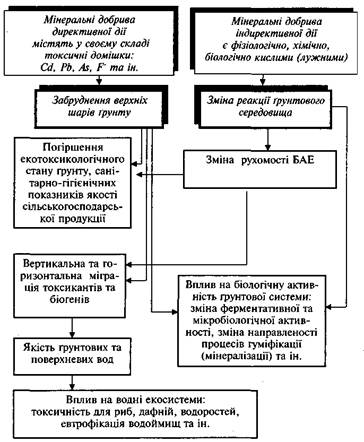
... рунтових вод, а також вод наземних водоймищ із впливом на екотоксикологічний стан водних екосистем. Характер впливу мінеральних добрив на агроекосистеми, передусім, зумовлений їхнім хімічним складом, що, у свою чергу, залежить від особливостей сировини та промислових технологій виробництва. Мінеральні добрива є джерелом надходження багатьох хімічних елементів (ХЕ) та сполук у довкілля. При їхній ...

0 комментариев