Навигация
Производство протеолитических ферментных препаратов
2. Производство протеолитических ферментных препаратов
Ферменты, обладающие способностью гидролизовать белки, широко используются в самых различных отраслях промышленности, сельском хозяйстве и медицине. Протеолитические ферменты выпускаются промышленностью в большом количестве, это крупнотоннажное производство. Протеиназы применяются в пищевой технологии, где идет процесс с использованием микроорганизмов (дрожжи, молочнокислые бактерии и др.). Введение в процесс протеиназ позволяет в результате гидролиза белков обрабатываемого сырья обеспечить дрожжам нормальные условия жизнедеятельности, что улучшает весь технологический процесс, особенно в пивоварении, спиртовой промышленности, виноделии. В ряде исследований показано, что протеолитические ферменты могут использоваться в хлебопечении для уменьшения длительности замесов при производстве заварных сортов хлеба и специальных изделий, изготавливаемых из муки с сильной клейковиной. Внесение в тесто небольших количеств амилаз и протеиназ увеличивает газообразование, улучшает аромат, цвет корочки и мякиша, позволяет сократить процесс тестоведения. Широко применяются протеиназы для снятия различного рода белковых помутнений в пивоварении и виноделии и для ускорения фильтрационных процессов. Протеолитические ферменты используются для мягчения (тендеризации) мяса, мясных изделий, рыбы, что облегчает и ускоряет обработку полупродуктов, повышает их качество. В мясной, рыбной промышленности и в кулинарии используются не только микробные протеиназы, но и протеиназы, получаемые из растительного и животного сырья. Высокоочищенные протеолитические ферменты могут с успехом использоваться в крахмало-паточной промышленности для выделения особенно чистого крахмала без сопутствующих белков.
Комплексные ферментные препараты, содержащие протеиназы, используются в пищеконцентратной и консервной промышленности при приготовлении концентратов из трудно развариваемых круп, гороха, фасоли и др.
Протеииазы могут использоваться в кожевенной промышленности для обработки кож в процессе их обезволашивания и мягчеиия с большим эффектом: улучшается качество шкуры, сохраняется толщина готовой кожи, отделенная щетина может использоваться как вторичное сырье, а главное – резко улучшаются условия труда работающих. Используются протеиназы при обработке натурального шелка для процесса снятия белка с поверхности шелковой нити.
Самая большая потребность в протеолитических ферментах связана с их использованием в составе синтетических моющих средств (CMC). Особенно эффективна обработка протеиназосодержащими CMC больничного белья, загрязненного кровью и другими выделениями белковой природы.
Протеолитические препараты, особенно животного происхождения, широко используются в медицинской промышленности и медицине. Они применяются для приготовления питательных и диагностических сред, для изготовления ряда лечебных сывороток и вакцин. Протеиназы различной степени очистки используются в качестве лекарственных препаратов для регулирования процессов свертывания крови, при лечении воспалительных процессов, для восполнения недостатка ферментов в организме и т. д.
2.1 Источники получения протеиназПротеолитические ферменты синтезируются практически всеми живыми существами. Эти ферменты очень широко распространены в природе. В промышленных целях как источник получения протеиназ используются животные ткани, растения и микроорганизмы. Животными тканями для получения протеиназ является собираемое на мясокомбинатах ферментное сырье, состоящее из поджелудочной железы и слизистой оболочки желудка. Из растений промышленный интерес представляют плоды дынного дерева, побеги и листья инжира и отходы переработки ананасов.
Наиболее широким и перспективным источником протеиназ являются микроорганизмы. Активными продуцентами протеиназ являются бактерии, микроскопические грибы и актиномицеты. Можно назвать сотни микроорганизмов, принадлежащих к различным таксономическим группам, которые используются при промышленном получении протеиназ. Они чаще всего относятся к родам Bacillus, Aspergillus, Penicillium, Streptomyces, Pseudomonas и некоторые другие. Более подробно о продуцентах будет сказано в разделе, посвященном рассмотрению особенностей производства протеолитических препаратов.
2.2 Механизм действия, свойства и классификация протеиназСубстрат. Субстратами для действия протеолитических ферментов являются пептиды и белки. К последним относятся простые белки, состоящие только из аминокислот, их называют протеинами, и сложные белки, в состав которых наряду с белковой частью молекулы входят соединения небелковой природы (углеводы, витамины, жиры и др.) – протеиды. Все эти соединения имеют большую молекулярную массу и сложны по строению.
Пептиды также могут быть субстратом для протеиназ. Они имеют более низкую молекулярную массу, чем белки, и по составу подобны простым белкам. Они могут быть либо продуктами неполного гидролиза белка, либо природными соединениями. Пептиды могут быть синтезированы в лаборатории и использоваться как специфические субстраты в аналитических работах для определения способности ферментов к разрыву вполне определенных пептидных связей.
До начала 50-х годов все протеолитические ферменты по механизму их действия на субстрат подразделялись на две группы: протеиназы и пептидазы. Считалось, что гидролиз белка протекает в две стадии: сначала под действием протеиназ белки гидролизуются до пептидов, а затем на пептиды действуют пептидазы и расщепляют их до аминокислот.
Позднее, в 60-х годах, протеолитические ферменты классифицировали на четыре подкласса. В настоящее время действует новая классификация, по которой протеиназы относятся к третьему классу четвертому подклассу. С тем чтобы исключить путаницу, все ранее существовавшие подклассы были отброшены и по новой классификации первому подклассу в разделе протеолитических ферментов присвоен номер 11 (КФ 3.4.11). Такие сложности в классификации связаны с тем, что катализируемая суммарная реакция одинакова для всех протеолитических ферментов. Причем ферменты не имеют строгой субстратной специфичности в обычном смысле этого слова – подавляющее большинство этих ферментов действует на все денатурированные и на многие нативные белки. По новой классификации протеолитические ферменты были разделены на две основные группы: пептидазы КФ 3.4.11 – 15 и протеиназы – КФ 3.4.21 – 24.
Пептидазы. В первой группе протеолитических ферментов – пептидазах – подразделение по подподклассам осуществляется на основе механизма расщепления пептидных связей в пептидах. К группе ферментов, входящих в 11-й подподкласс (КФ 3.4.11) – α-аминоацилпептидгидролазы – относятся те, которые гидролитически расщепляют первую с N-конца пептидную связь. Группа КФ 3.4.12 – гидролазы пептидиламинокислот или гидролазы ациламинокислот – объединяет ферменты, действующие на первую пептидную связь с С-конца. Ферменты группы КФ 3.4.13 – дипептидгидролазы – гидролизуют дипептиды; групп КФ 3.4.14 – дипептидилпептид гидролазы – и КФ 3.4.15 – пептидилдипептидгидролазы – гидролизуют дипептиды соответственно с N- и С-конца. С 16-го до 20-го подподкласса в номенклатуре сделан пропуск с учетом будущих открытий ферментов, гидролизующих дипептиды.
Протеиназы. Вторая группа протеолитических ферментов – протеиназы – имеет четыре подподкласса (21 – 24), в котором все ферменты подразделяются в зависимости от особенностей механизма катализа, установленного по функционированию активного центра фермента, а также влияния рН на его активность. Специфичность к субстрату рассматривается лишь с позиции идентификации индивидуальных ферментов в пределах каждой из групп.
Сериновые протеиназы. К подподклассу 3.4.21 относятся протеиназы, для которых характерно наличие в каталитическом центре триады аминокислот: аспарагиновая кислота, гистидин и серии. В этот подподкласс внесены многие хорошо изученные протеийазы животного происхождения (химотрипсин, трипсин, тромбин, плазмин, эластаза и др.) и некоторые микробные протеиназы.
Тиоловые протеиназы. К подподклассу 3.4.22 относятся протеиназы, имеющие в активном центре SH-группу цистеина.
В подподкласс 3.4.22 вошел ряд важных протеиназ растительного происхождения, такие как папаин, фицин, бромелаин, химопапаин, и некоторые микробные протеиназы.
Кислые протеиназы. Они входят в подподкласс (3.4.23) и имеют оптимальный рН ниже 5, в каталитическом акте у этих ферментов участвуют остатки дикарбоновых аминокислот. Наиболее широко известны из этого подподкласса пепсин, катепсин и ряд кислых протеиназ грибного происхождения. В последний под подкласс (3.4.24) входят протеиназы, содержащие ионы металлов. В основном это различные микробные нейтральные протеиназы и некоторые протеиназы животного происхождения.
В классификации и номенклатуре протеолитических ферментов выделена ещё одна, третья группа протеиназ, которые включены в подподкласс 3.4.99. Это протеиназы с неизвестным механизмом катализа. В этот подподкласс внесено 26 ферментов, среди них много микробных протеиназ, но есть протеиназы и животного происхождения. Создание подподкласса 3.4.99 вызвано тем, что многие протеиназы обладают близкой, но не полностью изученной и определенной специфичностью. Они действуют на один и тот же субстрат, однако продукты гидролиза отличаются не только количественно, но и качественно.
Отличительной особенностью многих протеолитических ферментов животного происхождения является то, что они в организме существуют в неактивном состоянии в виде зимогенов, которые только при определенных условиях могут превращаться в активные формы. Это трипсин, химотрипсин, карбоксипептидазы, А и В, пепсины, реннин, катепсины, аминопептидазы, дипептидазы, тромбин, плазмин и др. Многие из данных ферментов получены в кристаллическом виде. Они чаще используются в медицине. Механизм их действия, субстратная специфичность, механизм ингибирования и активации подробно изучены. Имеются данные о строении активного центра, а для некоторых протеиназ известна и структура самого фермента. Также глубоко и всесторонне изучены основные протеиназы растительного происхождения: папаин, фицин, бромелаин, химопапаин, которые за рубежом широко применяются в медицине и пищевой технологии.
2.3 Получение микробных протеиназВ Номенклатуру и классификацию ферментов внесено большое количество протеолитических ферментов микробного происхождения, которые относятся к различным подподклассам: 3.4.11 (7 ферментов), 3.4.13(5), 3.4.15(1), 3.4.16(1), 3.4.17(5), 3.4.21(4), 3.4.22(3), 3.4.23(1), 3.4.24(4) и 3.4.99(4). Необходимо отметить, что часто под одним номером находится очень много ферментов, получаемых из различных источников, но имеющих сходные свойства. Так, в подподклассе 3.4.21.14 представлена целая серия микробных протеиназ, среди продуцентов которых отмечаются Bacillus subtilis, E. coli, щелочная протеиназа из культур рода Aspergillus, Tritirachium album, Arthrobacter, Pseudomonas aeruginosa, Malbranchea pulchella, Streptomycer rectus, Candida lipolytica и др. Под номером 3.4.23.6 также объединено много ферментов, источниками которых являются микроорганизмы, в основном относящиеся к грибам родов: A. oryzae, A. terricola, A. saitoi, A. niger, P. janthinellum, R. chinensis, M. pusillus, M. miehei, Endothia parasitica, Candida albicans, Saccharomyces carlsbergensis, Rhodotorula glutinis, Physarum polycephalum и др. Все микробные металлопротеиназы объединены под номером 3.4.24.4. Они выделены из культур родов: Streptomyces, Sarcina, Micrococcus, Staphylococcus, Bacillus, Aeromonas, Pseudomonas, Escherichia, Aspergillus, Myxobacter, Serratia.
Однако в промышленности чаще всего получают комплекс протеолитических ферментов, достоинства которого определяются с учетом последующего применения ферментного препарата. Суммарная протеолитическая активность такого препарата определяется на соответствующем субстрате: гемоглобине, желатине, растительном белке, эластине, коллагене и т. д.
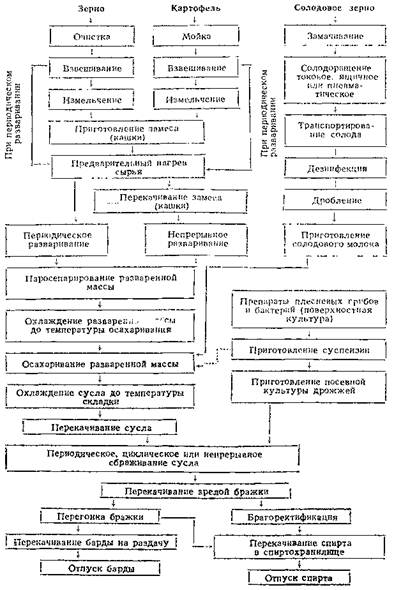
2.3.1 Технологические схемы производства микробных протеиназТехнологические схемы производства микробных протеиназ (см. рис. 1 и 5) отличаются друг от друга прежде всего на первой стадии получения микробной культуры продуцента, на стадиях выделения различия меньше.
2.3.2 ПродуцентыВ качестве продуцентов протеолитических ферментов при глубинном культивировании в промышленных условиях используют бактерии в основном рода Bacillus, реже – актиномицеты и микроскопические грибы. Способность к образованию протеолитических ферментов отмечается практически у всех известных микроорганизмов, так как роль этих ферментов в регуляции жизненных функций организмов очень велика. Протеолитические ферменты в подавляющем большинстве случаев являются внеклеточными.
Похожие работы
... MAX-LIFE U4 приводит к улучшению показателя стабильности теста. Препарат Grindamyl MAX-LIFE E5 грибного происхождения целесообразно применять при ускоренных технологиях. Ферментные препараты с гемицеллюлазной активностью действуют на нерастворимые высокомолекулярные пентозаны, содержащиеся в пшеничном тесте, увеличивают долю низкомолекулярных пентозанов, что способствует образованию более ...
... ферментный препарат МЭК-1 входят Амилосубтилин Г1Ох и Амилоразин П1Ох. Препарат МЭК-1 (мультиэнзимная композиция, тип I) представляет собой порошок светло-бежевого цвета влажностью 12...13 %. Амилолитическая активность препарата (АС) 2650 ед/г, протеолитическая (ПС) — 30 ед/г. Расход МЭК-1 составляет 50 г стандартного препарата на 1 т солодового зерна при замачивании. Препарат применяют в ...
... HAC. 3.1 Изучение морфолого-физиологических и культуральных свойств микроорганизмов Целью данного этапа эксперимента являлось выделение, изучение свойств микроорганизмов и определение их видовой принадлежности. Исследуемые культуры были выделены из сточной воды после эмульсионного обезжиривания меховой овчины. Изучаемые культуры были обозначены номерами 3,7, F, G, I, Iў. Получение чистых культур ...
... состава, а также с получением иммобилизованных форм различных ферментных препаратов. Источники 1. Датунашвили Е.Н. Применение ферментных препаратов в виноградном виноделии. — В кн.: Ферментные препараты в пищевой промышленности /Под ред. В.Л. Кретовича, В. Л. Яровенко. Москва, 1995; 2. Зинченко В.И. Применение цитолитнческого ферментного препарата в виноделии. — К., 1995; Калунянц К.А., ...


0 комментариев