Навигация
Регуляция синтеза протеиназ
2.3.3 Регуляция синтеза протеиназ
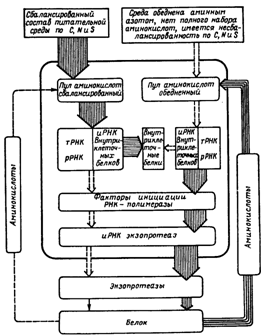
В самом общем виде гипотетический механизм регуляции биосинтеза внеклеточных протеаз у микроорганизмов представлен на рисунке 14. Авторы этой модели, основываясь на данных литературы и собственных исследованиях, предполагают, что иРНК-экзопротеазосинтезирующая система безуспешно конкурирует с системами других РНК вследствие низкого сродства специфических факторов инициации или РНК-полимеразы с участком инициации на экзобелковом гене. Известно, что синтез РНК контролируется либо соотношением ненагруженных и аминоацилированных тРНК (при этом свободные тРНК являются репрессорами синтеза), либо действием гуанозинтетрафосфата (ppGpp), который образуется при аминокислотном голодании и подавляет биосинтез РНК. Суть предлагаемой модели заключается в следующем. Присутствие в среде в достаточном количестве всех необходимых аминокислот и других источников углерода, азота и серы позволяет поддерживать внутриклеточный пул микроорганизма на высоком уровне. При этих условиях клетка осуществляет интенсивный синтез нетранслируемых РНК и иРНК для внутриклеточных белков. В результате содержание свободных факторов инициации РНК-полимеразы, которые могут принять участие в синтезе иРНК экзопротеаз, незначительно. Вероятно, этим объясняется низкая частота транскрипции иРНК экзопротеаз и, следовательно, низкий уровень образования внеклеточных протеаз, например, в начале роста культуры на такой сбалансированной среде (левая сторона схемы).
Истощение среды в процессе роста культуры по одному или нескольким субстратам приводит к снижению уровня пула внутриклеточных свободных аминокислот, что значительно снижает синтез РНК. В результате освобождаются РНК-полимераза и факторы инициации транскрипции РНК. Увеличиваются частота инициации иРНК экзопротеаз и соответственно синтез внеклеточных протеолитических ферментов (правая сторона схемы). При наличии в среде белков экзопротеазы расщепляют их до пептидов и аминокислот, которые поступают в клетку, пополняя ее пул. Аминокислоты утилизируются клеткой активно и являются лимитирующим субстратом. Поступающие в клетку аминокислоты могут полностью удовлетворить ее потребности, т. е. снять лимитирование по этому субстрату, что приведет к временному торможению биосинтеза экзопротеаз и т. д. Иными словами, имеет место механизм контроля синтеза экзопротеаз по типу метаболитной репрессии. Можно предположить, что регуляторное воздействие субстратов на биосинтез экзопротеаз проявляется на уровне транскрипции. Известно, что пул иРНК поддерживает синтез протеаз в течение нескольких часов.
Глубинным способом культивируют многие продуценты протеолитических ферментов. Для производства нейтральных и щелочных протеиназ используют спороносные бактерии и актиномицеты, для получения кислых – микроскопические грибы.
Наиболее широко в нашей стране применяются штаммы бактерий, относящиеся к видам Bacillus subtilis и В. mesentericus, на основе которых выпускаются препараты протосубтилин и протомезентерин разной степени очистки, предназначенные для самых различных отраслей – от пищевых технологий до использования в моющих средствах и сельском хозяйстве.
2.3.4 Питательные среды и условия культивированияПри конструировании оптимальных питательных сред для каждого продуцента изучаются его физиология, потребность в источниках N, С и других соединениях. Содержание сухого вещества в питательной среде в зависимости от продуцента может изменяться от 6 до 20 %. Питательные вещества могут вноситься в среду сразу или дробно по мере потребления из среды лимитирующего компонента. Оптимальный состав среды устанавливается либо путем длительного изучения особенностей биосинтеза ферментов микроорганизмом, либо с использованием математических методов планирования эксперимента.
Способ экспериментального конструирования питательной среды можно продемонстрировать на примере Bacillus subtilis 103 (табл. 3,).
| Таблица 3 | ||||
| Источник азота | рН | Содержание биомассы, г на 100 мл | Протеолитическая активность, мкг тирозина на 1 мл | |
| начальный | конечный | |||
| Цитрат аммония двузамещённый (контроль) | 6,90 | 7,50 | 0,84 | 66,8 |
| KN03 | 6,90 | 6,10 | 0,11 | 97,0 |
| NH4NO3 | 6,90 | 4,45 | 0,26 | 0 |
| (NH4)S04 | 6,90 | 4,80 | 0,40 | 66,8 |
| (NH4)2HP04 | 6,90 | 5,60 | 0,80 | 100,2 |
| NH4Cl | 6,95 | 7,40 | 0,40 | 67,0 |
| Двузамещённый фосфат аммония (контроль) | 6,9 | 5,6 | 0,80 | 100,2 |
| Казеин | 6,9 | 7,7 | 0,80 | 140,0 |
| Пептон | 6,9 | 7,5 | 1,00 | 187,7 |
| Кукурузный экстракт | 6,8 | 7,6 | 1,00 | 200,0 |
| Глютен | 7,0 | 6,8 | 0,74 | 56,8 |
| Вытяжка из солодовых ростков | 7,0 | 7,3 | 0,60 | 193,7 |
Культивирование проводилось на модифицированной среде Номура следующего состава (в %): картофельный крахмал – 2; двузамещённый цитрат аммония – 3; КСl – 0,15; MgSO4 – 0,05; СаС12 – 0,01; экстракт соевых бобов – 1,0. Если в составе среды изменять источник минерального азота (см. табл. 2.37), то биосинтез протеолитических ферментов будет заметно изменяться, особенно, если соль кислая, например NH4NO3. При потреблении аммонийного азота в среде накапливаются ионы азотной кислоты и среда резко подкисляется, и, хотя рост культуры и происходит, биосинтеза протеиназ не наблюдается. Если взять двузамёщенный фосфат аммония за контроль, то при изучении влияния различных источников органического азота для этого же штамма (табл. 4) оказалось, что уровень рН меняется меньше, чем с неорганическим азотом, и только в одном случае – с глютеном – биосинтез протеолитических ферментов ниже контрольного. Кроме того, введение в состав среды помимо (NH4)2HPO4 (1,2 %) кукурузного экстракта (0,8 %) и пивных дрожжей (0,4 %) позволило получить активность в культуральной жидкости до 1 300 ед. ПС/мл, т. е. почти в 20 раз больше контроля.
Экспериментальный способ оптимизации сред приемлем, но он очень длителен и не всегда оправдан, так как для того, чтобы учесть взаимовлияние отдельных компонентов при изменении их соотношения в среде, необходимо исследование многочисленных вариантов. Проще и целесообразнее вести такие исследования на основе математических методов планирования эксперимента.
Таким образом, способность бактерий образовывать внеклеточные протеиназы повысилась почти в 30 раз. Такие высокие показатели удалось достигнуть благодаря предварительной подработке некоторых компонентов сред, что убыстрило рост культуры и повысило её продуктивность. Подработка компонентов среды является эффективным и весьма распространенным приемом в технологии ферментных препаратов.
2.3.5 Выделение ферментов
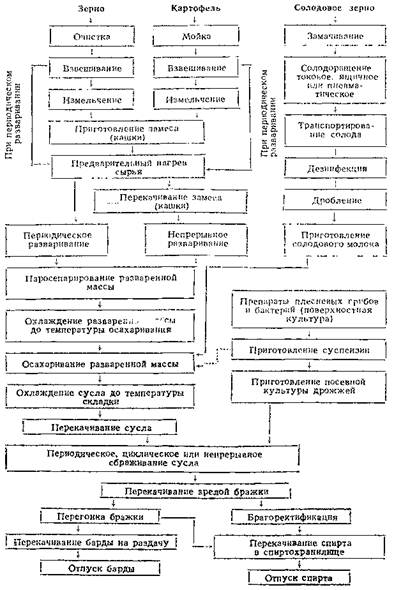
На основе культуральной жидкости, содержащей внеклеточные протеиназы, можно получить ферментные препараты различной степени очистки, используя разнообразные методы (см. рис. 1) – начиная от высушивания распылением готовой культуральной жидкости и до методов получения высокоочищенных ферментных препаратов и кристаллических протеиназ.
В таблице 4 представлены основные этапы выделения высокоочищенной протеиназы из технического препарата Г3х. Эта схема позволяет получить с высоким выходом (до 22 %) очищенный препарат внеклеточной нейтральной протеиназы из В. subtilis, которая относится к металлопротеиназам.
| Таблица 4 | ||
| Стадия выделения | Характеристика стадии | Выход активной протеиназы, % от исходной |
| Протосубтапин Г3х | Исходный материал для выделении протеазы | 100 |
| Растворение | Растворение протосубтилина в воде с рН 7,8 до концентрации сухого вещества 10 % | 92 |
| Отделение нерастворимой части | Фильтрование | 88 |
| Концентрирование | Очистка ультрафильтрацией и концентрирование до содержания белка в концентрате 3,5 – 4,0 % | 84 |
| Освобождение от пигмента | Обесцвечивание на ДЭАЭ-целлюлозе | 82 |
| Фракционирование ферментного комплекса | Хроматография на КМ-целлюлозе | 44 |
| Концентрирование элюата, получаемого при хроматографии | Обессоливание и концентрирование методом ультрафильтрации | 38 |
| Получение сухого высокоочищенного препарата нейтральной протеиназы | Сублимационная сушка концентрата | 22 |
Дальнейшие исследования протеолитических ферментов этого микроорганизма позволили установить в них четыре компонента, которые различались между собой по многим физико-химическим характеристикам (табл. 4), особенно по оптимуму рН. Из таблицы 6 видно, что протеиназа II обладает широким диапазоном действия в интервале рН от 7,5 до 11, протеиназа IV является сильнощелочной и т. д.
| Таблица 6 | |||||
| Компонент протеиназ | Молекулярная масса | Изоэлектрическая точка, pI | Оптимальный рН | рК | Кин, с-1 |
| I | 44 000 | 8,4 | 7,0 | 5,3; 8,8 | 0,9·10-3 |
| II | 40 000 | 8,8 | 7,5 – 11 | 5,7; 9,3; 9,8; 12,2 | 4,0·10-5 |
| III | 23 000 | 9,5 | 6,5 | 5,3; 7,7 | 3,3·10-4 |
| IV | 29 000 | 10,1 | 11,0 | 8,5 | 2,0·10-4 |
Наряду с этим очень продуктивным штаммом в промышленности всё больше используются другие бактериальные продуценты нейтральных и щелочных протеаз, которые являются мутантными вариантами или культурами, отобранными в процессе длительной естественной селекции. Среди промышленных бактериальных штаммов можно назвать: В. cereus, В. mesentericus, В. licheniformis (продуцент препарата субтилизин Карлсберга), В. amyloliquefaciens, В. stearothermophilus, В. subtilis (продуценты промышленных препаратов субтилизин BPN и субтилизин Novo) и некоторые другие.
Среди микроорганизмов – продуцентов протеиназ не менее важное место, чем бактерии, занимают актиномицеты и микроскопические грибы. Актиномицеты образуют внеклеточные протеиназы в значительных количествах, но они сравнительно редко используются в промышленных условиях. Очень многие актиномицеты одновременно с протеиназами образуют большое количество внутриклеточных антибиотиков, поэтому имеется возможность одновременно организовать два производства: антибиотиков – из биомассы продуцента и протеолитических ферментов – из жидкой фазы культуры. По такому принципу начиная с 60-х годов в Японии получают протеиназы на основе производства стрептомицина при промышленном культивировании Streptomyces griseus. Протеазы S. griseus получают из фильтрата глубинной культуры путем избирательной сорбции катионообменными смолами. Протеаза после элюции и дальнейшей очистки очищается в 22 – 25 раз и известна на мировом рынке под названием проназы. Проназа является комплексным препаратом, состоящим, по данным различных авторов, из 11 – 13 протеаз: четырех нейтральных, грех щелочных протеиназ и 3 – 5 аминопептидаз и карбоксипептидаз. Это стабильный ферментный препарат, обладающий широкой специфичностью и способностью глубоко (на 70 – 90 %) гидролизовать субстрат до аминокислот. Только кератин и фиброин шелка с трудом гидролизуются проназой. Проназа также гидролизует различные пептиды, амиды и эфиры аминокислот. Она растворима в воде, слабых солевых растворах, водных растворах ацетона и спиртов с концентрацией не выше 50%. Оптимальный рН лежит в щелочной зоне – от 8 до 9; при рН ниже 4 и выше 10 протеазы инактивируются. Стабилизируется проназа ионами кальция, нейтральные протеиназы и пептидазы проназы являются металлоферментами. Пептидазы ингибируются ЭДТА, причем в присутствии ионов кальция и кобальта этот эффект снимается.
Препараты проназы широко используются в различных отраслях промышленности, особенно при щелочных значениях рН. Препараты прекрасно хранятся при комнатной температуре и полностью сохраняют свою активность в течение 3 и более лет. Препараты проназы содержат ферменты, очень близкие по механизму своего воздействия на субстрат к трипсину и химотрипсину. Поэтому в литературе можно встретить для трипсиноподобных протеиназ проназы с различными названиями: протеиназа В, БАЭЭ-гидролаза; трипсин S. griseus, трипсин проназы и т. д. Протеиназы проназы со свойствами, близкими к химотрипсину, в литературе называются: протеиназа С, протеаза А, n-нитрофенилацетатгидролаза 1 и 2, фракция В, эластазоподобный фермент, эндопептидаза В, химотрипсин проназы и др. Следует отметить, что химотрипсинподобный фермент S. griseus обладает высокой эластазной активностью. Вероятно, это комплексный фермент, имеющий в своем составе фрагмент эластазного фермента. Наличие в препаратах проназы пептидаз, вероятно, способствует более полному расщеплению белков и пептидов до аминокислот.
Микроскопические грибы очень длительное время использовались для синтеза нейтральных и особенно кислых протеиназ. Наиболее часто для этих целей применялись различные виды аспергилловых грибов: A. oryzae, A. flavus, A. fumigatus, A. terricola, A. sojae, P. chrysogenum, Monilia sitophila. Эти микроорганизмы образуют протеазы, зона действия которых лежит в интервале рН от 4 до 10 с проявлением максимальной активности при рН, близком к нейтральному. Большой интерес представляют продуценты видов: A. awamori, A. saitoi, Rhizopus javanicus, Rh. pygmaues, Penicillium expansum, P. sponolasum и др., которые образуют кислые протеиназы с оптимальным рН 2,0 – 2,5. Все кислые протеиназы по механизму воздействия на субстрат достаточно близки, но пока нет стройной гипотезы, объясняющей существо протекающей реакции и её механизм.
За рубежом выпускаются кислые пепсиноподобные протеиназы, используемые для гидролиза белков соевых бобов, для хлебопечения и в медицине для улучшения пищеварения. Наиболее широко для производства кислых пепсиноподобных внеклеточных протеиназ используются Aspergillus saitoi, Rhizopus chinensis и Penicillium janthinellum. Схема получения на основе этих культур препаратов классическая и особых отличий не имеет.
Подводя итог по характеристике протеолитических ферментов, следует подчеркнуть, что технология этих препаратов освоена наиболее широко. Это многотоннажное производство, объемы которого превышают по денежному выражению реализуемой продукции почти в 2 раза сумму реализации всех непротеолитических ферментов. Причем доля микробных протеаз составляет 1/2 общего объёма выпускаемых протеолитических ферментов. С учетом того, что из года в год область применения протеаз расширяется и объемы выпускаемой продукции возрастают, можно сказать, что это почти самое крупномасштабное производство в технологии ферментных препаратов. Проведены большие исследования протеаз, этому вопросу посвящены обширные работы, обзоры и монографии. В данном разделе книги сделана попытка лишь слегка коснуться основных особенностей производства протеолитических ферментных препаратов и подчеркнуть те стороны технологии, которые требуют ещё изучения и совершенствования.
2.4 Производственные стоки
Спуск ливневых и производственных сточных вод в канализационную сеть может проводиться только в соответствии с санитарными нормами промышленных предприятий («Санитарные нормы проектирования» СНиП II –32–74). Спуск воды из производственных корпусов должен осуществляться по трём отдельным канализационным устройствам: для отработанных чистых производственных вод (конденсатор, холодильники и т. п.); для загрязненных промышленных стоков; для фекально-хозяйственных вод. Условно чистые производственные воды должны быть предельно регенерированы с целью их повторного использования в производстве, и только в исключительных случаях допускается сбрасывание этих вод в канализацию. Производственные сточные воды, содержащие кислоты или щелочи, должны нейтрализоваться, после чего разрешается спуск их в заводскую сеть фокально-хозяйственной канализации. Спуск фекально-хозяйственных и загрязненных производственных сточных вод в поглощающие колодцы и буровые скважины запрещен.
Производственные сточные воды перед сбросом из цеха в наружную канализацию необходимо подвергать первичной очистке с целью извлечения, регенерации и утилизации ценных продуктов, максимального снижения концентрации органических веществ и минеральных солей. Следует проводить извлечение пожаро- и взрывоопасных газов, масел, смол, токсических веществ, которые не могут быть удалены при последующей биологической очистке сточных вод.
Сточные воды предприятий ферментной промышленности должны иметь следующие характеристики (в мг/л): химическая потребность в кислороде (ХПК) – не более 600; биохимическая потребность в кислороде (БПКполн) – не более 410; общий азот – 150; аммонийный азот – 30; азот нитратов – 33; фосфор – 1,3; крупнодисперсные вещества – 500; мутность незначительная; рН 7,0. Инфицированная культуральная жидкость перед спуском в канализацию должна быть простерилизована или прокипячена в течение 1 ч.
Биомасса продуцента при глубинном культивировании, если ее концентрация в сточных водах не превышает допустимой нормы по мутности и взвеси, может быть после стерилизации также присоединена к промышленным канализационным стокам.
При ферментных заводах, где отсутствует общегородская канализация и сброс сточных вод осуществляется непосредственно в водоемы, предусматривается строительство очистных сооружений для промышленных и хозяйственных стоков. Условия, место сброса сточных вод, метод и степень очистки их подлежат согласованию с Государственной санитарной инспекцией и Государственной инспекцией по охране рыбных запасов
Похожие работы
... MAX-LIFE U4 приводит к улучшению показателя стабильности теста. Препарат Grindamyl MAX-LIFE E5 грибного происхождения целесообразно применять при ускоренных технологиях. Ферментные препараты с гемицеллюлазной активностью действуют на нерастворимые высокомолекулярные пентозаны, содержащиеся в пшеничном тесте, увеличивают долю низкомолекулярных пентозанов, что способствует образованию более ...
... ферментный препарат МЭК-1 входят Амилосубтилин Г1Ох и Амилоразин П1Ох. Препарат МЭК-1 (мультиэнзимная композиция, тип I) представляет собой порошок светло-бежевого цвета влажностью 12...13 %. Амилолитическая активность препарата (АС) 2650 ед/г, протеолитическая (ПС) — 30 ед/г. Расход МЭК-1 составляет 50 г стандартного препарата на 1 т солодового зерна при замачивании. Препарат применяют в ...
... HAC. 3.1 Изучение морфолого-физиологических и культуральных свойств микроорганизмов Целью данного этапа эксперимента являлось выделение, изучение свойств микроорганизмов и определение их видовой принадлежности. Исследуемые культуры были выделены из сточной воды после эмульсионного обезжиривания меховой овчины. Изучаемые культуры были обозначены номерами 3,7, F, G, I, Iў. Получение чистых культур ...
... состава, а также с получением иммобилизованных форм различных ферментных препаратов. Источники 1. Датунашвили Е.Н. Применение ферментных препаратов в виноградном виноделии. — В кн.: Ферментные препараты в пищевой промышленности /Под ред. В.Л. Кретовича, В. Л. Яровенко. Москва, 1995; 2. Зинченко В.И. Применение цитолитнческого ферментного препарата в виноделии. — К., 1995; Калунянц К.А., ...


0 комментариев