Навигация
Коэффициент активности. Предельное значение коэффициента активности
5.3 Коэффициент активности. Предельное значение коэффициента активности
Из уравнения (13) можно записать
 (15)
(15)
При исследовании адсорбции из растворов условием стандартного состояния является отсутствие взаимодействия между молекулами растворенного вещества, а также с молекулами воды, которое нарушило бы ее структуру. Этому стандартному состоянию соответствует бесконечно разбавление органического компонента водой в равновесном растворе и адсорбционной фазе.
Рассмотрим предельное значение коэффициента активности при ![]() . Подставив
. Подставив ![]() в уравнение (14), получим:
в уравнение (14), получим:
![]() (16)
(16)
где ![]() – равновесная концентрация, соответствующая плотному заполнению адсорбционной фазы, т.е.
– равновесная концентрация, соответствующая плотному заполнению адсорбционной фазы, т.е. ![]() .
.
Наибольшему заполнению адсорбционной фазы соответствует равновесная концентрация, равная концентрации насыщенного раствора Cs:
![]() при
при ![]() (17)
(17)
Поскольку вид функции ![]() от θ в общем случае выражается кривой, которая монотонно изменяется от
от θ в общем случае выражается кривой, которая монотонно изменяется от ![]() (при
(при ![]() ) до
) до ![]() (при
(при ![]() ), для приближенного вычисления
), для приближенного вычисления ![]() при любом
при любом ![]() можно использовать широко распространенный в химической технологии прием «рабочей линии». Для этого на ординате при
можно использовать широко распространенный в химической технологии прием «рабочей линии». Для этого на ординате при ![]() откладывают величину
откладывают величину ![]() и соединяют эту точку с началом координат. Тогда приближенное значение
и соединяют эту точку с началом координат. Тогда приближенное значение ![]() при любом значении
при любом значении ![]() можно найти из соотношения:
можно найти из соотношения:
![]() (18)
(18)
На рис. 6 показано изменение ![]() от
от ![]() для нитробензола (дипольный момент равен 3,96D). Штриховая прямая получена для значений
для нитробензола (дипольный момент равен 3,96D). Штриховая прямая получена для значений ![]() , рассчитанных по растворимости.
, рассчитанных по растворимости.
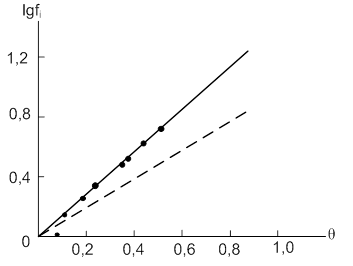
Рис.6. Зависимость lg fi от θ для молекул нитробензола, адсорбированного на угле КАД (штриховая линия рассчитана по растворимости)
Из рис. 6 видно, что до относительно заполнения ![]() эти прямые не совпадают. Еще более сильное диполь – дипольное отталкивание наблюдается в случае адсорбции n-нитроанилина (дипольный момент равен 6,17D).
эти прямые не совпадают. Еще более сильное диполь – дипольное отталкивание наблюдается в случае адсорбции n-нитроанилина (дипольный момент равен 6,17D).
Предельное значение коэффициента активности, таким образом, можно рассчитывать по константе адсорбционного равновесия и растворимости в тех случаях, когда диполь – дипольное отталкивание молекул в адсорбционной фазе отсутствует или незначительно (при малых дипольных моментах молекул).
5.4 Вычисление изотерм адсорбции органических веществ из водных растворов углеродными адсорбентами
Чтобы вычислить изотерму адсорбции, необходимо для разных значений заполнения адсорбционного объема ![]() (
(![]() ) рассчитать величины равновесной концентрации и удельной адсорбции. Значения равновесных концентраций (
) рассчитать величины равновесной концентрации и удельной адсорбции. Значения равновесных концентраций (![]() , ммоль/л) вычисляют по формуле
, ммоль/л) вычисляют по формуле
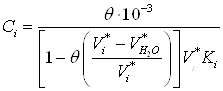 (19)
(19)
где ![]() – степень заполнения адсорбционного объема, задаваемая нами (0,1; 0,2; 0,3 и т.д.);
– степень заполнения адсорбционного объема, задаваемая нами (0,1; 0,2; 0,3 и т.д.); ![]() и
и ![]() - молярные объема извлекаемого органического вещества воды.
- молярные объема извлекаемого органического вещества воды.
Если известна структурная формула извлекаемого из воды вещества, то суммированием инкрементов ![]() для составных частей и структуры находят величину
для составных частей и структуры находят величину ![]() , а затем вычисляют константу адсорбционного равновесия по формуле
, а затем вычисляют константу адсорбционного равновесия по формуле
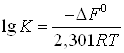 (20)
(20)
Удельную адсорбцию рассчитывают по формуле (в ммоль/г)
![]() (21)
(21)
Поскольку предельный коэффициент активности определяется соотношением ![]() , для разных значений констант адсорбционного равновесия
, для разных значений констант адсорбционного равновесия ![]() можно рассчитать те концентрации, при которых предельный коэффициент активности равен 1. Рассчитанные концентрации, соответствующие коэффициентам активности
можно рассчитать те концентрации, при которых предельный коэффициент активности равен 1. Рассчитанные концентрации, соответствующие коэффициентам активности ![]() при разных значениях
при разных значениях ![]() приведены в табл. 1.
приведены в табл. 1.
Таблица 1.
Значения концентраций насыщенных растворов, для которых fi = 1 при разных значениях ![]()
|
| К при 25ºС | Сs при 25ºС (рассчитанное), моль/м3 |
| 16,75 21 23 25,1 | 872 4800 11200 25700 | 63,5 11,5 4,95 2,16 |
Расчет изотерм адсорбции только по константе адсорбционного равновесия ![]() возможен для веществ, у которых соотношения между константами адсорбционного равновесия и величинами растворимости близки к указанным в табл. 1. [2]
возможен для веществ, у которых соотношения между константами адсорбционного равновесия и величинами растворимости близки к указанным в табл. 1. [2]
Похожие работы
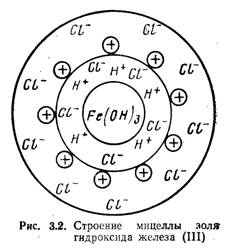
... не только электролитами, но и взаимодействием противоположно заряженных коллоидов, наступающим при адсорбции одного коллоида поверхностью другого. Этот процесс играет некоторую роль при осветлении воды коагулированием. Необходимым условием взаимной коагуляции является равенство противоположных зарядов частичек золей. При несоблюдении этого условия коагуляция протекает либо неполно, либо вовсе не ...
... , параметров термодинамического взаимодействия Флори — Хаггинса для систем полимер — растворитель, а также для исследования кинетики кристаллизации полимеров из расплава. Основы метода обращенной газовой хроматографии 1. Основные положения теории газовой хроматографии как метода физико-химических измерений. В основе физико-химических измерений с помощью газовой хроматографии лежит связь между ...
... 4 5. » 80 » 125 5 6. » 125 » 250 7 7. » 250 » 450 10 9. » 400 » 800 14 Глава 3. Электрофизический способ очистки и обеззараживания питьевой воды 3.1 Очистка воды с помощью нанотехнологий Качество питьевой воды имеет огромное значение для здоровья людей. Все чаще водопроводная вода по своему составу напоминает химическую и бактериологическую смесь, опасную для нашего здоровья. ...
... работу насоса. • Установить уровнемеры с показаниями рабочего и аварийного уровня воды в фильтрах и в резервуаре W= 10000 м3. 3. Эколого-экономическая часть 3.1 Очистка подземных и поверхностных вод по озоно-сорбционной технологии для хозяйственного назначения Производительность 10-300 м3 /час; Состав исходной воды: взвешенные вещества — 127 мг/л; нефтепродукты — 0,31 мг/л, жесткость — ...
0 комментариев