Навигация
M (прод) = 60*1000/24=2500кг/ч
1. m (прод) = 60*1000/24=2500кг/ч
2. Найдем массовый процентный состав продуктов:
на 100 моль смеси:
32 моль CH4 m=32*16=512кг/ч
18 моль CH3Cl m = 18*50,45=908,1 кг/ч
25 моль CH2Cl2 m = 25*84,9=2122,5 кг/ч
20 моль CHCl3 m = 20*119,35=2387 кг/ч
5 моль CCl4 m = 5*153,8=769 кг/ч
всего: 6698,6 кг/ч
Wмас (СН4) = 512/6698,6*100% = 7,64%
Wмас (СН3Cl) = 908,1/6698,6*100% = 13,56%
Wмас (CH2Cl2) = 2122,5/6698,6*100% = 31,69%
Wмас (CHCl3) = 2387/6698,6*100% = 35,63%
Wмас (CCl4) = 769/6698,6*100% = 11,48%
Состав продуктов:
mост (СН4) =2500*0,0764=191кг/ч
m (СН3Cl) =2500*0,1356=339кг/ч
m (CH2Cl2) =2500*0,3169=792,25кг/ч
m (CHCl3) =2500*0,3563=890,75кг/ч
m (CCl4) =2500*0,1148=287кг/ч
Wост (СН4) =191/16=11,94кмоль/час
W (СН3Cl) = 339/50,45=6,72кмоль/час
W (CH2Cl2) = 792,25/84,9=9,33кмоль/час
W (CHCl3) = 890,75/119,35=7,46кмоль/час
W (CCl4) = 287/153,8=1,87кмоль/час
Прореагировало хлороформа: Wпр (CHCl3) = W (CCl4) = 1.87 кмоль/ч
Образовалось хлороформа: Wо (CHCl3) = Wпр + W = 1.87 + 7.46 = 9.33 кмоль/ч.
Прореагировало хлористого метилена: Wпр (CH2Cl2) = Wо (CHCl3) = 9.33 кмоль/ч.
Образовалось хлористого метилена: Wо (CH2Cl2) = Wпр + W = 18.66 кмоль/ч
Прореагировало хлористого метила: Wо (CH2Cl2) = Wо (CH2Cl2) = 18.66 кмоль/ч.
Образовалось хлористого метила: Wо (CH2Cl2) = Wпр + W = 18.66 + 6.72 = 25.38 кмоль/ч.
Прореагировало метана: Wпр (СН4) = 25.38 кмоль/ч
Всего подано на реакцию: W (СН4) = Wпр + Wо = 25.38 + 11.94 = 37.32
mо (СН4) = 37.32 * 16 = 597.12
Всего подано метана с учетом потерь: mвсего (СН4) - 100%,
597.12 - 98.7%
mвсего (СН4) = 597.12 * 100/ 98.7 = 604.88 кг/ч
W (СН4) = 604.88/16 = 37.81 кмоь/ч
mп (СН4) = 604.88 - 597.12 = 7.76 кг/ч
W (СН4) = 7.76,16 = 0.485 кмоь/ч
Количество превращенного кислорода и образовавшегося HCl:
1 р - я:
W1 (Cl2) = W1 (HCl) = Wо (СН3Cl) = 25.38 кмоль/ч
2 р - я:
W2 (Cl2) = W2 (HCl) = Wо (CH2Cl2) = 18.66 кмоль/ч, 3 р - я:
W3 (Cl2) = W3 (HCl) = Wо (CHCl3) = 9.33 кмоль, 4 р - я:
W4 (Cl2) = W4 (HCl) = W (CCl4) = 1.87 кмоь/ч
Wо (Cl2) = W3 (HCl) = 55.24 кмоль/ч
m о (Cl2) =55.24 * 70.9 = 3916.52 кг/ч
m о (HCl) = 55.24 * 36.45 = 2013.5 кг/ч
Хлор с учетом избытка:
Wвсего (Cl2) = 2.6 * Wвсего (СН4) = 98.306 кмоль/ч
mвсего (Cl2) = 98.306 * 70.9 = 6969.9 кг/ч
Избыток:
mизб (Cl2) = mвсего (Cl2) - mо (О2) = 6969.9 - 3916.52 = 3053.38 кг/ч
Wизб (Cl2) = 3053.38/70.9 = 43.07 кмоль/ч
Подано природного газа (примесь метана):
604.88 - 93%
х - 7%
х = m (пр. газ) = 604.88 * 7/93 = 45.53 кг/ч
Подано примесей хлора:
6969.9 - 98.5%
х - 1.5%
х = mприм (Cl2) = 6969.9 * 1.5/98.5 = 106.14
Технологические и технико-экономические показатели
Пропускная способность установки:
m (CH4) + m (Cl2) + m (прим Cl2) + (прим CH4) = 7726,45 кг/ч
Конверсия или степень превращения метана:
![]() = M (CH4) подано - M (CH4) непрореагировало / M (CH4) подано * 100%
= M (CH4) подано - M (CH4) непрореагировало / M (CH4) подано * 100%
![]() = 604,88 - 198,76/604,88* 100% = 67%
= 604,88 - 198,76/604,88* 100% = 67%
Теоретические расходные коэффициенты:
по СН4:
sтСН4 = Mr (CH4) / Mr (CH3Cl) = 16/50,45 = 0,317 кг/кг;
sтСН4 = Mr (CH4) / Mr (CH2Cl2) = 16/84,9 = 0,188 кг/кг;
sтСН4 = Mr (CH4) / Mr (CHCl3) = 16/119,35 = 0,134 кг/кг;
sтСН4 = Mr (CH4) / Mr (CCl4) = 16/153,8 = 0,104 кг/кг;
по Cl2:
sт Cl2 = Mr (Cl2) / Mr (CH3Cl) = 70,9/50,45 = 1,405 кг/кг.
sт Cl2 = Mr (Cl2) / Mr (CH2Cl2) = 70,9/84,9 = 0,835 кг/кг.
sт Cl2 = Mr (Cl2) / Mr (CHCl3) = 70,9/119,35 = 0,594 кг/кг.
sт Cl2 = Mr (Cl2) / Mr (CCl4) = 70,9/153,8 = 0,461 кг/кг.
Фактические расходные коэффициенты:
по СН4:
sфСН4 = m (CH4) / m (CH3Cl) = 604,88/339 = 1,78 кг/кг;
sфСН4 = m (CH4) / m (CH2Cl2) = 604,88/792,25 = 0,764 кг/кг;
sфСН4 = m (CH4) / m (CHCl3) = 604,88/890,75 = 0,679 кг/кг;
sфСН4 = m (CH4) / m (CCl4) = 604,88/287 = 2,108 кг/кг;
по Cl2:
sфCl2= m (Cl2) / m (CH3Cl) = 6969,9/339 = 20.56 кг/кг.
sфCl2= m (Cl2) / m (CH2Cl2) = 6969,9/792,25 = 8,798 кг/кг.
sфCl2= m (Cl2) / m (CHCl3) = 6969,9/890,75 = 7,825 кг/кг.
sфCl2= m (Cl2) / m (CCl4) = 6969,9/287 = 24,285 кг/кг.
Выход на поданное сырье:
Фактический выход CCl4:
QФ = m (CCl4) = 287 кг;
Теоретический выход CCl4:
Mr (СН4) ¾ Mr (CCl4), 16 ¾ 153,8,m (СН4) ¾ QТ; 604,88 ¾ QТ;
QТ = (604,88 * 153,8) / 16 = 5814,409 кг;
Выход CCl4:
bCCl4 = QФ / QТ * 100%= 287 кг / 5814,409 кг * 100% = 4,936%.
Список литературы
1. Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. Изд. 2-е, пер. М., "Химия", 2005, 736 с.
2. Юкельсон И.И. Технология основного органического синтеза. М.: "Химия", 2008, 846 с.
3. Расчеты химико-технологических процессов / Под ред. И.П. Мухленова. Л.: Химия, 2008, 300 с.
Похожие работы
... радикал (изопропил); (СН3)3С— - третичный одновалентный радикал (mpem-бутил). 1.2. Номенклатура и изомерия Номенклатура. Для названия предельных углеводородов применяют в основном систематическую и рациональную номенклатуры. Названия первых четырех членов гомологического ряда метана тривиальные: метан, этан, пропан, бутан. Начиная с пятого названия образованы от греческих числительных с ...
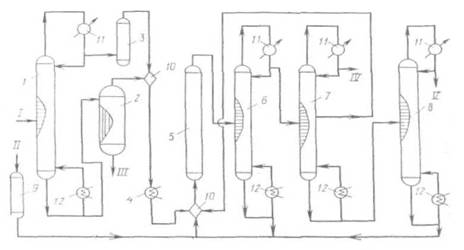
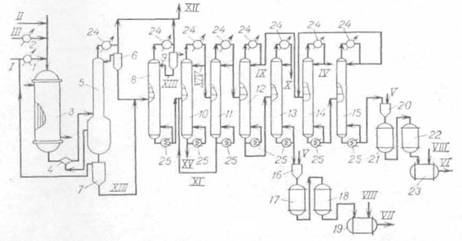
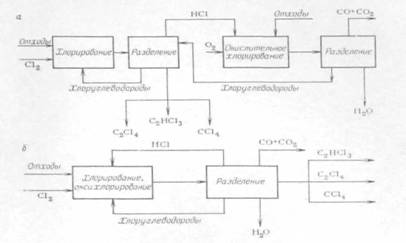
... СС12=СС12 + 5НС1 (2.26) Побочно получаются продукты конденсации (гексахлорбутадиен-1,3, гексахлорбензол), которые в этих условиях не подвергаются хлоролизу, и их уничтожают. Технологическая схема производства тетрахлорметана и тетрахлорэтилена из хлорорганических отходов изображена на рис. 2.1. Смесь отходов подают в испаритель 1, где отделяются тяжелые продукты, направляемые на сжигание. Пары ...
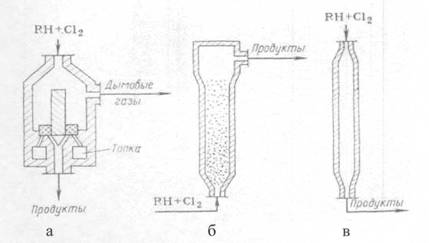
ие химические превращения их, большое внимание уделял реакциям галоидирования, в том числе хлорирования углеводородов и их производных. Капитальным вкладом в разработку теоретических основ реакций хлорирования парафиновых углеводородов явились известные исследования В.В. Марковникова по теории взаимного влияния атомов в молекулах химических соединений. Пользуясь большим экспериментальным ...
... - С=С - Н + ЗН2 Эта реакция дегидрирования (отщепления водорода) имеет большое промышленное значение, так же как и дегидрирование других предельных углеводородов, в том числе этана С2Н6: Углеводороды нормального строения под влиянием катализаторов и при нагревании подвергаются реакциям изомеризации и превращаются в углеводороды разветвленного строения: пентан 2-метилбутан Применение метана ...

0 комментариев