Навигация
Мембранные методы выделения, концентрирования и обогащения продуктов биосинтеза
16. Мембранные методы выделения, концентрирования и обогащения продуктов биосинтеза
В настоящее время все большее распространение приобретают мембранные методы концентрирования и выделения различных веществ, хотя до сих пор в ряде производств БАБ (включая антибиотики, например, пенициллин) не удалось отказаться от традиционных способов выделения и очистки целевых продуктов (экстракция в системе "жидкость-жидкость", адсорбция на активированных углях, диализ).
Мембранные фильтры широко применяются в конструкциях небольших ячеек для культивирования клеток. Такие ячейки предназначены, как правило, для изучения действия факторов окружающей среды на популяцию клеток, обычно чистых культур, которые высеяны внутри ячейки. Во многих конструкциях ячеек использовались мембраны для ультрафильтрации или диализа (см. [230]), но микрофильтрационные мембраны намного лучше, поскольку они обеспечивают значительно более быструю диффузию питательных веществ и продуктов метаболизма клеток.
В зависимости от назначения можно конструировать ячейки самых разных типов. Главная идея состоит в том, чтобы диффузионная ячейка была изготовлена из инертного материала (плексигласа, поликарбоната) и включала в себя два мембранных фильтра, разделенных между собой достаточно большим просветом, необходимым для роста культуры клеток. Края мембранных фильтров должны быть хорошо загерметизированы, чтобы предотвратить подтекание растворов, но в то же времяотбор проб и демонтировка устройства не должны вызывать затруднений.
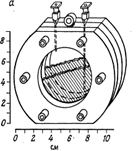
Рис. 11.1. Ячейка для культивирования, содержащая диализную мембрану для изучения загрязненности воды, а — схематическое изображение (из работы [149]); б — фото ячейки (любезно предоставлено Г. Мак-Фетерсомг Государственный университет Монтаны, США).
Загрязнение поверхности мембран особенно существенно, если ячейки работают на открытом воздухе, хотя в зависимости от характера эксперимента это может происходить и в лабораторных условиях. Органические вещества, бактерии и другие материалы могут легко адсорбироваться мембранными фильтрами и изменять их поверхность столь существенно, что ячейка для культивирования перестает работать, как положено. В сущности микроорганизмы, способные подвергать биодеградации матрицу мембраны (например, бактерии, разлагающие целлюлозу), могут образовывать колонии на внешней стороне мембраны и изменять характеристики ее проницаемости настолько, что она перестает функционировать должным образом.
Небольшие подвижные микроорганизмы, такие, как спирохеты, могут проникать через мембранные фильтры с размером пор 0,45 мкм. Хотя спирохеты, по-видимому, не могут пройти через мембраны с порами 0,22 мкм, скорость установления равновесия при "работе с мембранами со столь небольшими порами будет еще меньше по сравнению с той, которую мы рассмотрели выше, так что использование таких мембран будет малоэффективным. Из вышесказанного очевидно, что ячейки для культивирования этого типа будут работать должным образом лишь в том случае, если плотность популяции микроорганизмов вну+ри камеры невелика, и только при коротких периодах инкубации. Работа Мак-Фетерса и Стюарта [149] по выживанию ФКП в естественных водах была проведена с низкими плотностями популяции этих бактерий, и продолжительность опытов не превышала нескольких дней, так что использование подобных ячеек было оправдано. Другие области применения ячеек для культивирования в микробиологических исследованиях: для изучения процесса интродукции микроскопических грибов в почву с последующим анализом под электронным микроскопом. Репортер привел описание ячейки с мембранными фильтрами для изучения взаимодействия между корневыми .клетками растений и бактериями вида Rhizobium japonicum.
17. Особенности стерилизации разных субстратов. Горячая и холодная стерилизацияПод стерилизацией сред обычно понимают любой метод воздействия, обеспечивающий удаление из них микробов — контаминантов или разрушение последних. Наиболее распространенным и универсальным среди возможных методов, вызывающих деструкцию микроорганизмов, является метод, основанный на использовании влажного тепла.
Тепловую стерилизацию сред (по способу ее проведения) подразделяют на периодическую и непрерывную. При периодическом способе стерилизации процессы: нагрев, выдержка и охлаждение среды (рис. 98) протекают последовательно во време ни в одном аппарате. Это может быть ферментатор, посевной аппарат или специальный стерилизатор. Весь объем среды нагревают в аппарате до заранее выбранной температуры, выдерживают при этой температуре строго определенное время и охлаждают водой, подаваемой в рубашку аппарата или змеевик. Метод отличается простотой и надежностью, однако имеет и свои недостатки. В частности, ухудшается качество питательной среды из-за длительного воздействия высокой температуры, при этом происходит карамелизация Сахаров (образование ангидридов Сахаров), деструкция витаминов; излишне длительный нагрев приводит не только к разрушению питательных веществ, но и к образованию в среде потенциальных ингибиторов процесса ферментации, таких как аминосахара. Второй недостаток связан с тем, что требуется повышенный расход пара за короткий период нагрева. Третий недостаток обусловлен невозможностью регенерировать тепло. Последний, четвертый, недостаток касается трудности автоматизации процесса периодической стерилизации по сравнению с непрерывным.
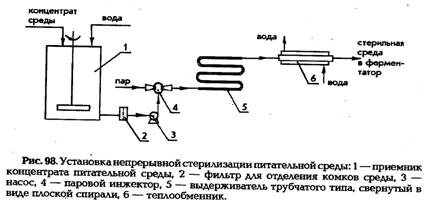
При непрерывном способе стерилизации каждый элементарный процесс — нагрев, выдержка, охлаждение осуществляется в специально предназначенных для этого аппаратах: нагревателе, выдерживателе, теплообменнике, которые со ставляют систему аппаратов для непрерывной стерилизации — установку непрерывной стерилизации (УНС). Непрерывная стерилизация имеет следующие преимущества по сравнению с периодической:
1) при непрерывном методе стерилизации каждый элементарный объем среды (бесконечно малый объем, содержащий одну спору) находится при высокой температуре короткое время;
2) благодаря более высоким температурам стерилизации и короткой экспозиции деструкция компонентов питательной среды минимальна;
3) процесс стерилизации всего объема питательной среды растянут во времени, этим обеспечивается более равномерная загрузка котельной;
4) процесс легко контролируем и управляем;
5) возможна частичная регенерация тепла.
Холодная стерилизация осуществляется в отношении некоторых жидкостей, растворы которых нельзя стерилизовать при высоких температурах, так как при этом происходит их испарение или инактивация витаминов и других биологически активных соединений, разложение лекарственных веществ, карамелизация сахаров, денатурация белков и т.п. В этих случаях осуществляют «холодную» С., при которой жидкости фильтруют через мелкопористые бактериальные фильтры. Стерилизация фильтрованием показана для синтетических сред определенного состава, содержащих термолабильные аминокислоты, витамины, белки, для антибиотиков, ароматических углеводородов. Фильтрование проводится через мелкопористые материалы, которые адсорбируют клетки микроорганизмов: каолин, асбест, фарфор и др. Диски, изготовленные из асбеста с целлюлозой называют фильтрами Зейтца. Их помещают в специальный фильтродержатель и стерилизуют в автоклаве, а затем, смонтировав держатель с колбой или бутылью, под давлением пропускают стерилизуемый раствор. Широкое применение нашли мембранные фильтры. Их изготавливают из специально обработанной нитроцеллюлозы. Фильтры имеют поры размером от 0,22 до 100 мм. В фильтродержатели монтируют фильтры с разной величиной пор, от больших к меньшим и при фильтрации растворов постепенно «отсеивают» микроорганизмы различных размеров. Наиболее широко известны фильтрующие пластины фирм «Миллипор», «Синпор», «Владипор». После стерилизующей фильтрации среды и растворы обязательно проверяют на стерильность, помещая микропробы простерилизованных растворов в термостат при температуре 37 ° С.
18. Аппаратура и способы стерилизации воздуха
Для стерилизации воздуха в микробиологической промышленности используют стеклянную и простую вату, ткань Петриянова, базальтовое волокно или фильтры из активного угля. Иногда для стерилизации воздуха применяют комбинирование термической обработки, фильтрации и ультрафиолетового облучения. Для очистки воздуха от микрофлоры можно использовать аппараты типа скрубберов, в которых сверху разбрызгивается дезинфицирующее вещество—10%-ная гидроокись натрия или 15—20%-ный раствор серной кислоты. В этих аппаратах нельзя применять такие дезинфицирующие вещества, которые, попадая с потоком воздуха в ферментатор, помешали бы процессу биосинтеза.
Для обеспечения кислородом культуры микроорганизмов в условиях аэробного процесса глубинной ферментации через единицу объема питательной среды в минуту необходимо подать 0,5—2 ед. объема воздуха. Его надо очистить от механических частиц, микроорганизмов и химических веществ перед введением в ферментатор. Для очистки воздуха в микробиологической промышленности обычно используют фильтрацию. Воздух подают обычно под давлением 0,2 МПа (2 кгс/см2). Для сжатия воздуха чаще всего используют турбокомпрессоры или поршневые компрессоры. Перед подачей в компрессор воздух очищается от грубых частиц на масляных фильтрах. В ферментатор он проходит сначала через общий, затем через индивидуальный фильтр. Эти фильтры выполняют функцию холодной стерилизации воздуха, отделяя клетки микроорганизмов. Как общие, так и индивидуальные фильтры заполняют гранулированным зернистым и волокнистым фильтровальным материалом, используя гранулированный уголь (КАД по ТУМХП 3136—52) и стеклянную вату, диаметр которой равен 18 мкм (ГОСТ 5174—49). В последнее время начали использовать специальные бактерицидные волокна. Толщина фильтрующего слоя обычно 0,4—0,75 м. Индивидуальные фильтры часто заполняют стеклянной, хлопчатобумажной ватой или активным углем.
Длительность стерилизации фильтров 1—1,5 ч при температуре 120—126°С. После стерилизации их сушат в потоке сухого воздуха в течение 2—3 ч. Фильтры необходимо стерилизовать не реже одного раза в месяц, а также после попадания инфекции.
Фильтрующий материал в индивидуальных фильтрах меняют один раз в 1—2 мес, а в общих фильтрах — через 6—8 мес.
Литература
Технология гидролизных производств. Шарков В. И., Сапотниц-кий С, А., Дмитриева О, А., Туманов И. Ф. «Лесная промышленность»,
1973 г., 408.
Биотехнология/под ред. И. Хиггинса, Д. Беста, Дж. Джонса/пере-вод с английского/под ред. А. А. Баева. -- М.: Мир, 1988. -- 479 с.
Глик Б. Молекулярная биотехнология. Принципы и применение. –М.: Мир, 2002.
Бекер М.Е. Введение в биотехнологию. – Рига: Звайгєне, 1974.
Похожие работы
... инновационных технологических решений, способный трансформировать их в конкурентный продукт для конечного использования. 3. Основные направления и перспективы развития технологических процессов прокатного и кузнечнопрессового производства Основные направления деятельности должны формироваться из круга проблем и вопросов, стоящих перед предприятиями и организациями. К ним нужно отнести ...
... сельского хозяйства и предпринимательства. Возрастут объемы инвестирования в интеллектуальный капитал как наиболее эффективный объект размещения ресурсов. Инвестиции в основной капитал в 2010 году по сравнению с 2005 годом увеличатся в 1,65 - 1,75 раза. 3. Наукоемкие отрасли и производства в развитых странах Какие конкретно отрасли промышленности можно отнести сегодня к наукоемким? Как ...
... куриных эмбрионов при культивировании, например, вируса гриппа, некоторые тканевые культуры млекопитающих и т.д., а также органические и неорганические вещества, используемые в биотехнологическом процессе, которые при попадании в окружающую среду могут послужить причиной экологической катастрофы. Поэтому на предприятии должны быть созданы условия для предотвращения хищений подлежащих уничтожению ...
... хозяйства, использования методов биотехнологии и биоинженерии. В этих целях нами совместно с учеными ведущих вузов, НИИ РАСХН и РАН разработан Инновационный проект по биотехнологии в агропромышленном производстве на 2004-2007гг. Этот проект предлагается как межведомственный, финансируемый Минпромнауки РФ и Минсельхозом РФ. Он отражает назревшие экономические и технологические проблемы сельского ...
0 комментариев