Навигация
6. Титриметрический анализ
Сущность метода заключается в измерении объема раствора того или иного реагента, израсходованного на реакцию с анализируемым компонентом. Для этих целей используют так называемые титрованные растворы, концентрация которых (титр) известны. Титром называется масса вещества, содержащегося в 1 мл титрованного раствора (г/мл). Определение проводят способом титрования, т.е. постепенного приливания титрованного раствора к раствору анализируемого вещества, объем которого точно измерен. Титрование прекращается при достижении точки эквивалентности, т.е. достижения эквивалентности реагента титруемого раствора и анализируемого компонента.
Существует несколько разновидностей титриметрического анализа: кислотно-основное титрование, осадительное титрование, комплексонометрическое титрование и окислительно-восстановительное титрование.
В основе кислотно-основного титрования лежит реакция нейтрализации
Н+ + ОН- Û Н2О
Метод позволяет определить концентрацию кислоты или катионов, гидролизирующихся с образованием ионов водорода, титрованием раствором щелочи или определить определить концентрацию оснований, в том числе анионов, гидролизирующихся с образованием гидроксид-ионов титрованием растворов кислот. Точка эквивалентности устанавливается при помощи кислотно-основных индикаторов, изменяющих окраску в определенном интервале рН. Например, методом кислотно-основного титрования можно определить карбонатную жесткость воды, т.е. концентрацию НСО3- в воде путем титрования ее раствора HCl в присутствии индикатора метилового оранжевого
НСО3- + Н+ Û Н2О + СО2
В точке эквивалентности желтая окраска индикатора переходит в бледно-розовую. Расчет производится по уравнению закона эквивалентов
Сэк.НСО3-·V1= Сэк.HCl·V2,
Где V1,V2 – объемы анализируемого и титрованного растворов; Сэк.HCl - нормальная концентрация эквивалентов вещества HCl в титрованном растворе; Сэк.НСО3- -определяемая молярная концентрация эквивалентов ионов НСО3- в анализируемом растворе. При осадительном титровании анализируемый раствор титруется реагентом, образующим с компонентом титрованного раствора малорастворимое соединение. Точка эквивалентности определяется с помощью индикатора, образующего с реагентом окрашенное соединение, например, красный осадок Ag2CrO4 при взаимодействии индикатора К2CrO4 с избытком ионов Ag+ при титровании раствора хлорида раствором нитрата серебра.
7. Комплексометрическое титрование
При комплексонометрическом титровании определяемый компонент в растворе титруется раствором комплексона, чаще всего этилендиаминотетрауксусной кислоты (ЕДТА, комплексона П) или ее двунатриевой соли (комплексона III или трилона Б). Индикаторами точки эквивалентности обычно служат лиганды, образующие с анализируемым ионом окрашенное комплексное соединение.
8. Окислительно-восстановительное титрование
Данный способ заключается в титровании раствора восстановителя титрованным раствором окислителя или в титровании раствора окислителя титрованным раствором восстановителя. В качестве титрованных растворов окислителей нашли применение растворы перманганата калия КМпО4 (перманганатометрия), дихромата калия К2Сг207 (дихроматометрия), иода 12 (иодометрия). При перманганатометрическом титровании в кислой среде Мп (VII) (малиновая окраска) переходит в Мп (II) (бесцветный раствор). Например, перманганатометрическим титрованием можно определить содержание нитритов в растворе.
2КМпО4 + 5KNO2 + 3H2SO4 = 2MnSO4 + K2SO4 + 5KNO3 + 3H2O
Итак, существует большое число разновидностей количественного химического анализа, позволяющих определять разнообразные вещества в широких пределах концентраций. Среди химических методов анализа наиболее распространены титрометрические и гравиметрические методы.
9. Инструментальные методы анализа
Инструментальные метода анализа обладают многими достоинствами: быстротой анализа, высокой чувствительностью, возможностью одновременного определения нескольких компонентов, сочетания нескольких методов, автоматизации и использования компьютеров для обработки результатов анализа. Как правило, в инструментальных методах анализа применяются сенсоры (датчики), и, прежде всего химические сенсоры, которые дают информацию о составе среды, в которой они находятся. Остановимся на некоторых методах, основанных на законах и принципах, рассмотренных ранее в данном курсе химии.
Похожие работы
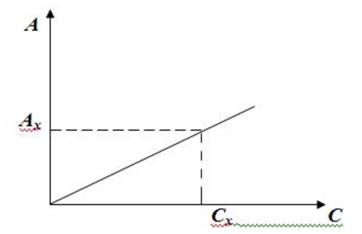
... свет вещества и толщине слоя раствора, через который он проходит. Закон Бугера - Ламберта - Бера является основным законом светопоглощения и лежит в основе большинства фотометрических методов анализа. Математически он выражается уравнением: или Величину lg I /I0 называют оптuческой плотностью поглощающего вещества и обозначают буквами D или А. Тогда закон можно записать так: ...
... следующим образом (табл.2.1.1). Кроме перечисленных в таблице существует множество других частных ФХМА, не подпадающих под данную классификацию. Наибольшее практическое применение имеют оптические, хроматографические и потенциометрические методы анализа. Таблица 2.1.1. Вид энергии возмущения Измеряемое свойство Название метода Название группы методов Поток электронов (эле- ...
... анализа, что делает его одним из наиболее точных методов (наряду с классическим весовым анализом). 7.2 Дериватография коррозия бетон термических физический превращение Комплексный метод исследования химических и физико-химических процессов, происходящих в образце в условиях программированного изменения температуры, который основан на сочетании дифференциального термического анализа (ДТА) с ...
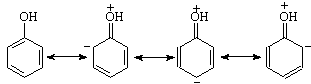
... даются обволакивающие средства и анальгетики, подается О2 с обеспечением адекватной вентиляции легких, производится коррекция водноэлектролитного баланса. 7. Физико-химические методы определения фенола 7.1 Фотоколориметрическое определение массовой доли фенолов в очищенных производственных сточных водах после установки обессмоливания фенол химический токсический получение 1. Цель работы. ...




0 комментариев