Навигация
1.2 Применение
Применение пероксида водорода связано с его окислительной способностью и с безвредностью продукта его восстановления (Н2О).
Его используют для отбелки тканей и мехов, в пищевой промышленности (при консервировании пищевых продуктов), в сельском хозяйстве для протравливания семян, а также в производстве ряда органических соединений, полимеров, пористых материалов. Как сильный окислитель пероксид водорода используется в ракетной технике. [3]
В медицине растворы H2O2 используют в качестве средств, обладающих антисептическими, дезинфицирующими свойствами. Они применяются для полоскания и смазывания при воспалительных заболеваниях слизистых оболочек (стоматиты, ангина), для лечения гнойных ран. [4]
3% и 6% водные растворы пероксида водорода (с добавками моющих средств) используются в качестве моюще-дезинфицирующих средств в аптечных, клинических, детских дошкольных и других учреждениях. Однако широкое их применение сдерживается низкой стабильностью: при добавлении моющих средств к раствору пероксида водорода, последний разрушается и быстро теряет «активный» кислород. По этой причине рабочие растворы моюще-дезинфицирующих средств на основе H2O2 готовят непосредственно перед применением, а срок их хранения составляет всего несколько часов. [5]
В литературе имеются сведения о большом количестве стабилизаторов H2O2. Наибольшее распространение получили органические и неорганические кислоты. Однако они оказывают раздражающее действие на кожу и слизистые оболочки, поэтому их применение ограничено. Именно поэтому в настоящее время является актуальным изучение влияния поверхностно-активных веществ (ПАВ) на разложение водных растворов ПВ различной концентрации. Одним из таких ПАВ является твин-80.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1 Влияние различных катализаторов на скорость разложения пероксида водорода
Уравнение реакции разложения:
![]()
![]() 2Н2О2 2Н2О + О2
2Н2О2 2Н2О + О2
Исследовалось влияние на скорость разложения Н2О2 следующих катализаторов: оксида марганца (IV) MnO2; оксида железа (III) Fe2O3; активированного угля С; перманганата калия KMnO4; хлорида железа (III) FeCl3; дихромата калия K2Cr2O7. [6]
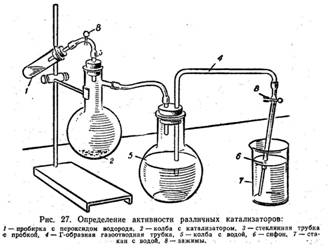
Рис. 1. Прибор для определения активности различных катализаторов
Опыты проводились в следующей последовательности:
1. Проверялась герметичность прибора (см. рисунок и фотографию выше), для чего закрываются пробки и открываются зажимы 8: вода не должна вытекать в стакан.
2. В пробирку 1 наливаем 5 смі пероксида водорода (6%-ного) и перекрываем резиновую трубку зажимом 8.
3. В колбу 2 вносим катализатор и вставляем в неё трубку 3, соединенную с пробиркой1.
4. Выравниваем давление внутри прибора с атмосферным давлением. С этой целью открываем зажим 8 сифона 6 и поднимаем стакан 7 с водой так, чтобы вода в нём и в колбе находилась на одинаковом уровне, и затем снова закрываем зажим.
5. Воду выливаем из стакана и наливаем в него точный её объем – 100смі, предварительно отмерив его мензуркой.
6. Опускаем кончик сифона 6 в стакан 7 с водой.
7. Открываем оба зажима 8 на приборе и быстро вливаем раствор пероксида водорода в колбу 2 с катализатором.
8. Через 3минуты вновь приводим давление внутри прибора к атмосферному давлению.
9. Закрываем зажимы сифона 6 и измеряем объем воды, вытесненной в стакан кислородом.
10. Из измеренного объема воды вычитаем 100смі, т.е. объем воды, ранее добавленной в стакан.
Результаты опытов отражены в таблице 1:
Таблица 1.
| № п./п. | Катализатор | Объем выделившегося кислорода, смі |
| 1 | Оксид железа (III) Fe2O3 | 9 |
| 2 | Активированный уголь С | 5 |
| 3 | Перманганат калия KMnO4 | 3 |
| 4 | Хлорид железа (III) FeCl3 | 10 |
| 5 | Дихромат калия K2Cr2O7 | 8 |
| 6 | Оксид марганца (IV) MnO2 | 7 |
В случае с перманганатом калия наблюдалось образование оксида марганца (IV), что указывает на протекание окислительно-восстановительной реакции, которую можно отразить следующим уравнением:
3H2O2 + 2KMnO4 2MnO2 + 3O2 + 2KOH + 2H2O
Поэтому говорить о KMnO4 как катализаторе не приходится. С учетом опытных данных располагаем испытанные катализаторы в порядке возрастания их каталитической активности:
Активированный уголь, оксид железа (III), дихромат калия, хлорид железа (III), оксид марганца (IV).
Похожие работы
... и, конечно же, за многими другими, которые будут получены, — будущее. В этом направлении и работают многие НИИ и исследователи. Аспекты поиска новых лекарств, изыскание новых лекарственных веществ состоит из трех основных этапов: химический синтез, установление фармакологической активности и безвредности (токсичности). Такая стратегия поиска с большой затратой времени, реактивов, животных, труда ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
... некоторых видов бактерий, так что его присутствие в речной воде и участие в процессах каталитического разложения вполне закономерно. Генерация свободных радикалов в природных водах может происходить и без участия перекиси водорода. Причем в роли инициаторов могут активно выступать органические соединения, характерные для речной воды. Такие процессы происходят в гумусовых веществах в результате ...
... №3 – 2%, №5 – 2%, №7 – 1%). 2.7. Изучение микробиологических показателей колбас при использовании исследуемых добавок. Бактериологические исследования опытных образцов вареных колбас проводили в Центральной научно-методической ветеринарной лаборатории и в лаборатории кафедры ветеринарно-санитарной экспертизы МГУПБ согласно ГОСТ 9958-81 (п.2.2.3.). Для изучения динамики бактериологических ...

0 комментариев