Навигация
Конденсация серной кислоты
10. Конденсация серной кислоты
Конденсация парой серной кислоты. В некоторых случаях, газ, используемый для получения серной кислоты, не содержит вредных примесей (мышьяка, фтора). Тогда экономически целесообразно не подвергать такой газ промывке в специальной аппаратуре, а передавать сразу на контактирование. Обычно его не подвергают также осушке, поэтому такой процесс называют мокрым катализом (например, получение серной кислоты из сероводорода). Газ, поступающий на стадию получения серной кислоты, содержит SO3 и Н20, и образование серной кислоты происходит не в результате абсорбции серного ангидрида растворами кислоты, а вследствие образования паров H2SO4 и конденсации их в башне с насадкой или другой аппаратуре, предназначенной для этого процесса.
Процесс конденсации более интенсивен (идет с большой скоростью), чем процесс абсорбции. Кроме того, конденсация протекает при высокой температуре, что облегчает отвод и использование тепла.
При медленном охлаждении газа, содержащего SO3 и Н2О, можно провести процесс конденсации паров серной кислоты без образования тумана. Однако скорость процесса при этом мала и часто экономически выгоднее вести охлаждение с большей скоростью, допуская образование некоторого количества тумана, а затем выделить этот туман из газовой смеси. Чтобы туман легче осаждался в фильтрах, процесс ведут при таких условиях, в которых образуются крупные капли. Этому соответствует невысокое значение возникающего пересыщения и более высокая температура орошающей кислоты, чем при обычном процессе абсорбции ("горячая" абсорбция).
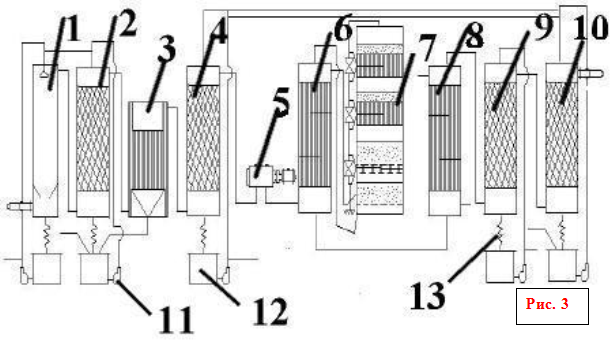
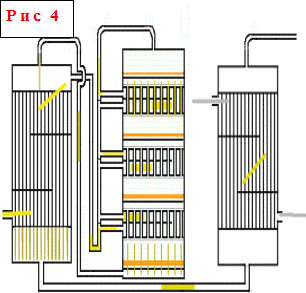
Конденсация кислоты идет внутри стеклянных трубок, в которые поступает технологический газ, содержащий пары кислоты. Внутри стеклянных трубок расположены спирали, служащие в качестве центров для осаждения серной кислоты. На конце каждой трубки установлен патронный фильтр (каплеотбойник), предназначенный для улавливания тумана серной кислоты. Внешняя поверхность труб (межтрубное пространство) охлаждается атмосферным воздухом. Очищенный газ с остаточной концентрацией серной кислоты менее 20 ррм и температурой не более 120 градусов цельсия сбрасывается в дымовую трубу.
Около 35 % (масс.) серной кислоты конденсируется в объеме, при этом пары превращаются в капли жидкости, переходят в туман и уносятся потоком газа.
Давление пара в котле-утилизаторе поддерживается достаточно высоким, чтобы температура теплообменных поверхностей. котла была выше точки росы серной кислоты (275 °С).
Несконденсированный газ из башни-конденсатора по футерованному газоходу через гидравлический затвор поступает в мокрые электрофильтры. Последние предназначены для улавливания изгазов тумана серной кислоты концентрацией 93— 94 % (масс.). Гидравлический затвор может также служить брызгоуловителем. Очищенный газ выводится в атмосферу. Для первоначального прогрева катализатора в контактном аппарате используют пусковой подогреватель, в котором воздух нагревается за счет сжигания топливного газа.
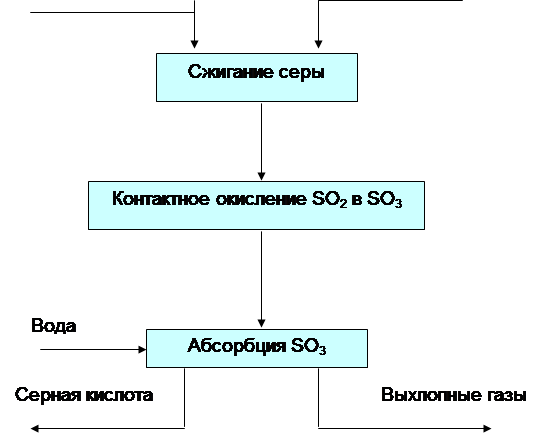
Использование башни-конденсатора в производстве серной кислоты позволяет снизить количество стадий: в место 4 стадий процесс протекает в 3.
1 стадия - это сжигание сероводорода в котлах-утилизаторах;
2 стадия – это окисление диоксида серы в контактном аппарате
3 стадия – это конденсация паров серной кислоты в конденсаторе.
Данный аппарат позволяет избежать процесса абсорбции, что, в свою очередь, снижает количество аппаратов
11. Термодинамический анализ процесса конденсации
Расчет теплового эффекта реакции конденсации SO3:
SO3 + H2O = H2SO4
![]() кДж
кДж
Q=-ΔН=174,26 кДж
Реакция экзотермическая- протекает с выделением тепла.
ΔS=![]() Дж
Дж
ΔG=ΔH-TΔS=-174,26-298*-288,07=-86019,12
Энергия Гиббса значительно меньше нуля. Это значит, что реакция термодинамически возможна.
Н2Ог = Н2Ож
Таблица 3
Значения термодинамических величин
| SO3 + H2O = H2SO4 | Н2Ог = Н2Ож | |
| ΔН | -130,26 кДж | -44 кДж |
| ΔS | -120,55Дж | -118,78 Дж |
| Q | 130,26 кДж | 44 кДж |
| ΔG | -165656,44 | -8603,56 |
Таблица 4
| ∑ | Значение ∑ 2-ух реакций |
| ΔН | -174,26 кДж |
| ΔS | -239,33 Дж |
| Q | 174,26 кДж |
| ΔG | -174260 |
При стандартных условиях реакция конденсации воды термодинамически возможна.
Реакция конденсации серной кислоты термодинамически возможна.
Расчет константы равновесия
DG=-R*T*lnKp
lgKp=-DG/2,3*8,31*Т
Kp=10-DG/19,113*Т
Таблица 5
Значения констант равновесия в зависимости от температуры
| Т,0С | Т,К | DG | Kp |
| 100 | 373 | -84989,9 | 5,8*10-4 |
| 200 | 473 | -61056,9 | 0,528 |
| 300 | 573 | -49090,4 | 45,43 |
| 400 | 673 | -37123,9 | 1,043*103 |
Из таблицы 5 видно, что с увеличением температуры реакции конденсации константа равновесия Кр падает.
Поэтому процесс конденсации целесообразно вести при повышенных температурах.
Похожие работы
... еще не всегда осуществима. В то же время отходящие газы – наиболее дешевое сырье, низки оптовые цены и на колчедан, наиболее же дорогостоящим сырьем является сера. Следовательно, для того чтобы производство серной кислоты из серы было экономически целесообразно, должна быть разработана схема, в которой стоимость ее переработки будет существенно ниже стоимости переработки колчедана или отходящих ...
... как температура газов снижается добавкой холодного воздуха между слоями. Абсорбция SO3 производится так же, как и в технологической схеме. Важнейшие тенденции развития производства серной кислоты контактным способом: 1) интенсификация процессов проведением их во взвешенном слое, применением кислорода, производством и переработкой концентрированного газа, применением активных катализаторов; ...
... образуется азотная кислота: NO(HSO4) + H2O®H2SO4 + HNO2 Она - то и окисляет SO2 по уравнению: SO2 + 2HNO2®H2SO4 + 2NO В нижней части башен 1 и 2 накапливается 75% - ная серная кислота, естественно, в большем количестве, чем её было затрачено на приготовление нитрозы (ведь добавляется «новорождённая» серная кислота). Окись азота NO возвращается снова на окисление. Поскольку некоторое количество ...
... . Для автоматического регулирования необходимо максимально знать требования, предъявляемые различным химико-технологическим процессом. 1.Основная часть 1.1 Технологический процесс получение серного ангидрида при получении серной кислоты. Производство серной кислоты контактным способом состоит из следующих действий: 1. Разгрузка, складирование и подготовка сырья ...


0 комментариев