Навигация
14. Расчет теплового баланса
| Стандартная энтальпия образования ΔH (298 К, кДж/моль) | Стандартная мольная теплоемкость Cp (298 К, Дж/моль·K) | Удельная теплоемкость C (кДж/кг•К) | ||
| SO2 | -296,90 | 39,90 | 0,62 |
|
| O2 | 0,00 | 29,35 | 0,92 |
|
| N2 | 0,00 | 29,10 | 1,04 |
|
| SO3 | -439,00 | 180,00 | 2,25 |
|
| H2O | -241,82 | 33,58 | 1,87 |
|
| H2SO4 | -814,20 | 138,90 | 1,42 |
|
| C4H10 | -124,70 | 97,78 | 1,69 |
|
| CO2 | -393,51 | 37,11 |
|
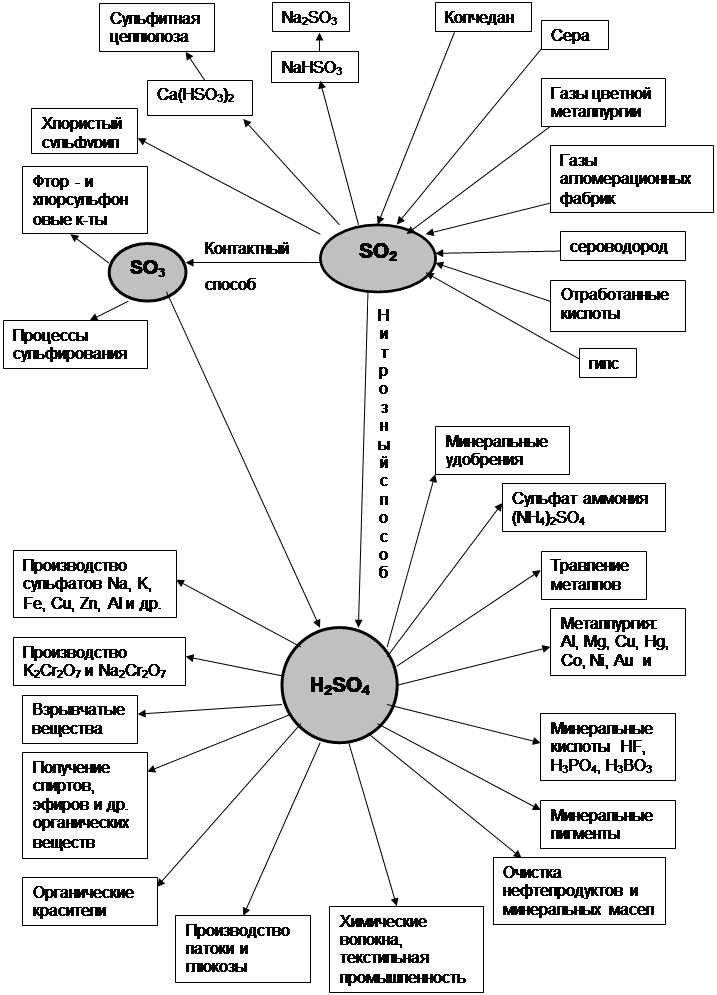
Тепловой баланс реакции окисления диоксида серы
SO2+1/2O2=SO3
| Приход | Теплота, КДж | Расход | Теплота, КДж |
| Q газа | 2 150 571,04 | Q газа | 4 230 053,62 |
| Q реакции | 6 274 032,19 | Q отвода | 4 194 549,61 |
| ∑ | 8 424 603,23 | ∑ | 8 424 603,23 |
Тепловой баланс реакции конденсации серной кислоты
SO3+H2O=H2SO4
| Приход | Теплота, КДж | Расход | Теплота, КДж |
| Q газа | 1 861 541,28 | Q газа | 236,98 |
| Q реакции | 11 920 708,00 | Q кислоты | 1 562 743,03 |
| Q отвода | 12 219 269,28 | ||
| ∑ | 13 782 249,28 | ∑ | 13 782 249,28 |
Из расчетов теплового баланса реакций окисления диоксида серы и конденсации серной кислоты видно, что в ходе этих реакций выделяется значительное количество тепла, которое необходимо отводить, что и делается в реальном технологическом процессе, для увеличения степени превращения этих реакций, а тепло утилизируют в различных целях как процесса, так и предприятия.
Похожие работы
... еще не всегда осуществима. В то же время отходящие газы – наиболее дешевое сырье, низки оптовые цены и на колчедан, наиболее же дорогостоящим сырьем является сера. Следовательно, для того чтобы производство серной кислоты из серы было экономически целесообразно, должна быть разработана схема, в которой стоимость ее переработки будет существенно ниже стоимости переработки колчедана или отходящих ...
... как температура газов снижается добавкой холодного воздуха между слоями. Абсорбция SO3 производится так же, как и в технологической схеме. Важнейшие тенденции развития производства серной кислоты контактным способом: 1) интенсификация процессов проведением их во взвешенном слое, применением кислорода, производством и переработкой концентрированного газа, применением активных катализаторов; ...
... образуется азотная кислота: NO(HSO4) + H2O®H2SO4 + HNO2 Она - то и окисляет SO2 по уравнению: SO2 + 2HNO2®H2SO4 + 2NO В нижней части башен 1 и 2 накапливается 75% - ная серная кислота, естественно, в большем количестве, чем её было затрачено на приготовление нитрозы (ведь добавляется «новорождённая» серная кислота). Окись азота NO возвращается снова на окисление. Поскольку некоторое количество ...
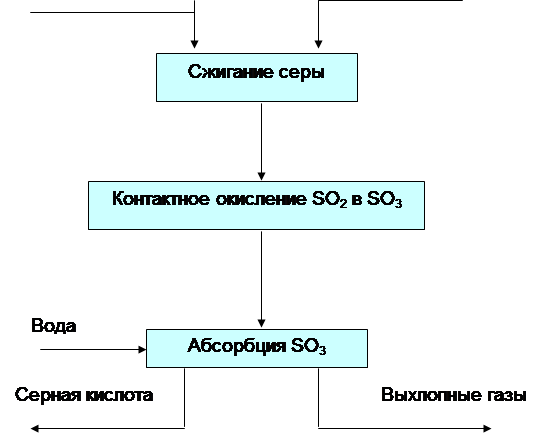
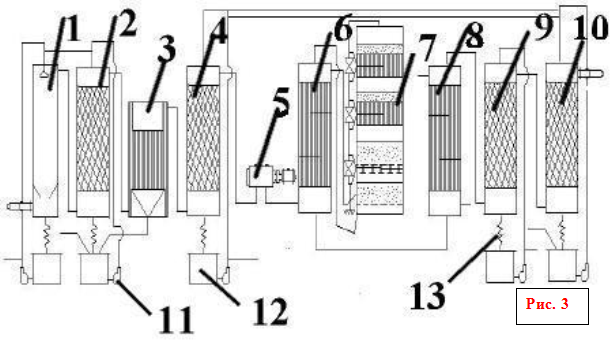
... . Для автоматического регулирования необходимо максимально знать требования, предъявляемые различным химико-технологическим процессом. 1.Основная часть 1.1 Технологический процесс получение серного ангидрида при получении серной кислоты. Производство серной кислоты контактным способом состоит из следующих действий: 1. Разгрузка, складирование и подготовка сырья ...


0 комментариев