Навигация
Окислительно-восстановительные реакции органических веществ
Контрольная работа по общей химии
12. Органическое вещество в виде летучей жидкости массой 0,1437 г при 250С и Р=99,2 кПа превращено в пар, занимающий объем 22,9 мл. Найдите молярную массу этого вещества.
Решение:
Уравнение состояния идеального газа (принимаем, что наш пар подчиняется этому уравнению) Клапейрона-Менделеева:
![]()
где ![]() – давление газа, Па;
– давление газа, Па; ![]() – объем газа, м3;
– объем газа, м3; ![]() – число молей газа;
– число молей газа; ![]() – универсальная газовая постоянная;
– универсальная газовая постоянная; ![]() – абсолютная температура.
– абсолютная температура.
При этом
![]()
где ![]() – масса газа, г;
– масса газа, г; ![]() – его молярная масса.
– его молярная масса.
![]() или это 298,15 K.
или это 298,15 K.
Тогда ![]() .
.
Ответ:![]() .
.
39. Сколько м3 пропена С3Н6 сгорело, если в результате образовалось 50 кг паров воды, если t = 300С, Р = 1,1атм?
Решение:
Уравнение реакции:
![]()
в уравнении ![]() .
.
Тогда использовав уравнение Клапейрона-Менделеева
![]() и
и ![]() ;
;
![]() ;
;
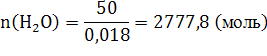
Получим
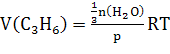 ;
; ![]() или это 303,15 K;
или это 303,15 K; ![]() ;
;
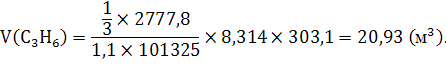
Ответ: ![]() .
.
62. Составьте электронные формулы атомов элементов с порядковыми номерами 14 и 40. Какие электроны этих атомов являются валентными?
Решение:
Элемент с порядковым номером 14 – кремний. Его электронная формула имеет вид: 1s22s22p63s23p2
Так как последний электрон находится на p-подуровне, то кремний относится к электронному p-семейству. Распределение электронов по квантовым ячейкам у атома кремния в нормальном состоянии:
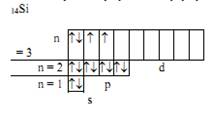
Валентные электроны для кремния – s- и p-электроны внешнего электронного уровня.
Элемент с порядковым номером 40 – цирконий. Его электронная формула имеет вид: 1s22s22p63s23p64s23d104p65s24d2. Так как последний электрон находится на d-подуровне, то цирконий относится к электронному d-семейству. Распределение электронов по квантовым ячейкам у атома циркония в нормальном состоянии:
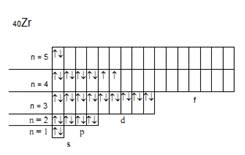
Валентные электроны для циркония – d-электроны предвнешнего и s-электроны внешнего электронного уровней.
Электронные и электронно-графические формулы элементов составлялись с учетом принципа Паули, правила Хунда и правила Клечковского.
87. Чем объясняется последовательное изменение окислительной способности свободных галогенов и восстановительной способности галогенид-ионов от фтора к йоду? Приведите примеры иллюстрирующих реакций.
Решение:
В ряду галогенов F2 - Cl2 - Br2 - I2 химическая активность и окислительная способность галогенов уменьшается, в связи с увеличением радиуса и уменьшением первого потенциала ионизации. Это можно проследить на примере реакции взаимодействия галогенов с водородом. Фтор взаимодействует с водородом с взрывом, выделяя при этом большое количество энергии. Хлор при обычных условиях очень медленно взаимодействует с водородом, но на прямом солнечном свету или при нагревании реакция идет также с взрывом. Реакция водорода и хлора протекает по цепному механизму, поэтому для нее необходимо инициирование (нагревание или освещение). Взаимодействие брома и йода с водородом происходит лишь при нагревании. Йод с водородом реагирует не полностью, т.к. йодоводород, образующийся при этом легко разлагается и равновесие сильно смещено в сторону исходных продуктов: Н2 + I2 <=> 2НI
| Свойства галогенов | F2 | Cl2 | Br2 | I2 |
| Радиус, нм | 0,072 | 0,099 | 0,114 | 0,133 |
| Первый потенциал ионизации кДж/моль (атомов) | 1682 | 1255 | 1142 | 1008 |
| Сродство к электрону, кДж/моль | 332,7 | 348,7 | 325 | 290 |
| Относительная электроотрицательность (по Полингу) | 4,0 | 3,01 | 2,8 | 2,6 |
Химическая активность галогенов от фтора к йоду уменьшается. Поэтому более активный галоген (имеющий наиболее высокое значение элетроотрицательности) вытесняет менее активный галоген из его соединений с металлами. Так, фтор вытесняет все другие галогены из их галогенидов, хлор – бром и иод, а бром – только иод:
2NаBr + С12 = 2NаС1 + Br2
2NаI + С12 = 2NаС1 + I2
2КI + Br2 = 2КBr + I2
2КBr + I2 ≠
Галогеноводородные кислоты (кроме HF) могут проявлять восстановительные свойства. Так как сродство к электрону (СЭ) в ряду галогенид-ионов уменьшается от Cl2 к I2, то восстановительные свойства в ряду HCl ‒ HBr – HI увеличиваются:
HCl + H2SO4 (конц. ) ≠
2НBr + H2SO4(конц.) = Br2 + SО2 + 2H2O
8НI + H2SO4(конц.) = 4I2 + H2S + 4H2O
В связи с усилением восстановительных свойств галогеноводородов от НС1 к HI падает устойчивость водных растворов галогеноводородных кислот к воздействию кислорода воздуха. При хранении на воздухе концентрированных растворов иодоводорода происходит его окисление:
4HI + О2 = I2 + 2Н2О
При этом раствор иодоводородной кислоты постепенно буреет:
HI + I2 = Н[I3]
Более медленно протекает аналогичный процесс и водном растворе НBr
Задания
Подберите коэффициенты в схемах окислительно-восстановительных реакций. Укажите окислитель и восстановитель.
Похожие работы
... , а в нейтральных и щелочных растворах ионы О реагируют с образованием гидроксид-ионов НОН + О = 2ОН . Применяются в основном два метода составления уравнений окислительно-восстановительных реакций: 1) электронного баланса – основан на определении общего количества электронов, перемещающихся от восстановителя к окислителю; 2) ионно-электронный – предусматривает раздельное ...
... электроны, понижает свою степень окисления, восстанавливается, а вещество Red2 с меньшим сродством к электрону (восстановитель) окисляется. Окисленная и восстановленная формы реагирующих в ОВР веществ образуют окислительно-восстановительные (оксред-, редокс-) пары ОХ1/Red1 и OX2/Red2, а превращения типа OX+ze - Red называют оксред - (редокс) - переходами или окислительно-восстановительными ...
... раствора; · присутствие катализатора. В большинстве случаев скорость реакции находится в прямой зависимости от температуры и рН раствора. Поэтому многие определения методом окислительно-восстановительного титрования следует проводить при определенном значении рН и при нагревании. Индикаторы окислительно-восстановительного титрования окислительный восстановительный титрование При анализе ...
... каротин, ксантофилл, ликопин, лютеин. Витамины имеют высокую физиологическую активность, сложное и разнообразное химическое строение. Они необходимы для нормального роста и развития организма. Витамины регулируют окисление углеводов, органических кислот, аминокислот, некоторые из которых входят в состав НАД, НАДФ. Биосинтез витаминов свойственен преимущественно зелёным растениям. В животных ...
0 комментариев