Навигация
112. Реакции № 12, 37, 62
Решение:
№12:
2Mn(NO3)2 + 5NaBiO3 + 16HNO3 = 2HMnO4 + 5Bi(NO3)3+ 5NaNO3 + 7H2O
Восстановитель: Mn(NO3)2
Окислитель: NaBiO3
| Окисление: | Mn2+ + 4H2O ‒ 5e- → MnO4- + 8H+ | 2 |
| Восстановление: | BiO3- + 6H+ + 2e- → Bi3+ + 3H2O | 5 |
| 2Mn2+ + 8H2O + 5BiO3- + 30H+ → 2MnO4- + 16H+ + 5Bi3+ + 15H2O 2Mn2+ + 5BiO3- + 14H+ → 2MnO4- + 5Bi3+ + 7H2O | ||
№37:
3HNO2 = HNO3 + 2NO + H2O
Восстановитель: HNO2
Окислитель: HNO2
Данная окислительно-восстановительная реакция относится к реакциям диспропорционирования, т.к. молекулы одного и того же вещества (HNO2) способны окислять и восстанавливать друг друга. Это происходит потому, что вещество HNO2 содержит в своем составе атомы азота в промежуточной степени окисления (3+). Следовательно, степень окисления способна как понижаться, так и повышаться.
| Окисление: | NO2- + H2O ‒ 2e- → NO3- + 2H+ | 1 |
| Восстановление: | NO2- + 2H+ + e- → NO + H2O | 2 |
| 3NO2- + H2O + 4H+ → NO3- + 2H+ + 2NO + 2H2O 3NO2- + 2H+ → NO3- + 2NO + H2O | ||
№62:
NH3 + KMnO4 + KOH = KCl + K2MnO4 + H2O
Некорректное условие – ошибка в реагентах (NH3) и продуктах реакции (KCl). Возможное правильное условие:
KCl + 8KMnO4 + 8KOH = KClO4 + 8K2MnO4 + 4H2O
Восстановитель: KCl
Окислитель: KMnO4
| Окисление: | Cl- + 8OH- ‒ 8e- → ClO4- + 4H2O | 1 |
| Восстановление: | MnO4- + e- → MnO42- | 8 |
| Cl- + 8OH- + 8MnO4- → ClO4- + 4H2O + 8MnO42- | ||
143. При сгорании 1 л бутана С4Н10 выделилось 119,1 кДж теплоты. Вычислить энтальпию образования бутана. Условия нормальные.
Решение:
Уравнение реакции:
![]()
![]() ;
;
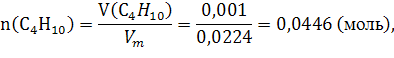
При сгорании ![]()
![]() выделяется
выделяется ![]() теплоты, а при сгорании
теплоты, а при сгорании ![]()
![]() –
– ![]() теплоты, тогда
теплоты, тогда
119,2/2=x/0,0446;
x=2,65 (кДж).
Ответ: выделится ![]() .
.
162. Возможно ли при 2000С протекание следующей реакции:
СО + 0,5О2 = СО2?
Решение:
Возможно ли при 2000С протекание следующей реакции: СО + 0,5О2 = СО2?
О принципиальной возможности и направлении процесса позволяют судить величина и знак ΔG (энергия Гиббса).
ΔG = ΔH – TΔS,
![]()
![]() где ΔH – изменение энтальпии реакции; ΔS – изменение энтропии реакции; Т – температура.
где ΔH – изменение энтальпии реакции; ΔS – изменение энтропии реакции; Т – температура.
![]() - стандартная энтальпия образования вещества
- стандартная энтальпия образования вещества
- стандартная энтропия образования вещества
п - количество вещества
| СО (газ) | О2 (газ) | СО2 (газ) | |
|
| -110,5 | 0 | -393,5 |
|
| 197,9 | 205 | 213,6 |
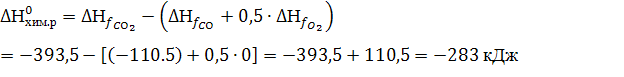

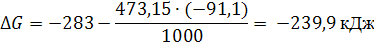
При ΔG<0 реакция самопроизвольно протекает в прямом направлении.
Ответ: возможно, так как ![]() – отрицательная величина.
– отрицательная величина.
189. Температурный коэффициент скорости реакции равен 3. Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры от 140 до 1700?
| Дано: | Решение: Согласно правилу Вант-Гоффа при повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два - четыре раза. Уравнение, которое описывает это правило следующее:
где Отсюда:
|
| γ = 3 Т1 = 140о Т2 = 170о | |
|
|
Ответ: Скорость реакции увеличится в 27 раз.
222. Как повлияет на выход хлора в системе :
4 HCl(г) + О2(г) « 2 Cl2(г) + 2 Н2О(ж), Q = 202,4 кДж,
а) повышение температуры в системе,
б) уменьшение общего объема смеси,
в) уменьшение концентрации кислорода,
г) увеличение общего объема реактора,
д) введение катализатора?
Решение:
4HCl(г) + О2(г) « 2Cl2(г) + 2Н2О(ж), Q = 202,4 кДж
Прямая реакция происходит с выделением тепла, т.е. является экзотермической (Q > 0), следовательно, обратная реакция будет протекать с поглощением тепла, т.е. является эндотермической (Q < 0). Согласно принципу Ле Шателье, если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-нибудь из условий (температура, давление, концентрация), то равновесие смещается таким образом, чтобы компенсировать изменение.
а) повышение температуры в системе будет способствовать сдвигу равновесия в сторону реакции, протекающей с поглощением тепла (эндотермической), т.е. в сторону реакции образования исходных веществ – выход хлора при этом уменьшится.
б) уменьшение общего объема смеси приведет к смещению равновесия в сторону реакции, протекающей с образованием меньшего числа молей газообразных веществ, т.е. в сторону прямой реакции – выход хлора при этом увеличится.
в) при уменьшении концентрации кислорода равновесие сдвигается в направлении образования исходных веществ – выход хлора при этом уменьшится.
г) при увеличении общего объема реактора давление в системе уменьшится, потому равновесие сдвинется в сторону увеличения числа газовых молей, т.е. в сторону обратной реакции – выход хлора при этом уменьшится.
д) катализатор одинаково ускоряет как прямую, так и обратную реакции и поэтому на смещение равновесия влияния не оказывает, а только способствует более быстрому его достижению, поэтому введение катализатора на выход хлора не повлияет.
237. Составьте схему, напишите уравнения электродных процессов гальванического элемента, у которого один электрод цинковый с концентрацией ионов цинка 10-2 моль/л, а второй – водородный с концентрацией ионов водорода 10-2 моль/л. Рассчитайте э.д.с. этого элемента.
Решение:
Схема химической цепи:
поток электронов
![]()
![]()
Электрод восстановитель (донор электронов) Электрод окислитель (акцептор электронов
![]()
где ![]() и
и ![]() – соответственно потенциалы положительного и отрицательного электродов.
– соответственно потенциалы положительного и отрицательного электродов.
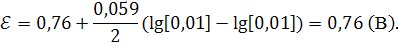
Ответ: Э.Д.С. равно ![]() .
.
262. Напишите уравнения реакций процессов, протекающих на электродах при электрохимической защите стальных труб.
Решение:
Одним из вариантов электрохимической защиты стальных труб есть протекторная защита. Если в качестве протектора взять цинк, то уравнения реакций процессов, протекающих на электродах будут следующие:
анодный процесс:
Zn – 2e- = Zn2+;
катодный процесс: в кислой среде –
2Н+ + 2е- = Н2↑;
в нейтральной среде –
1/2О2 + Н2О + 2е- = 2ОН-.
286. Вычислить рН 0,001 М раствора фтористоводородной кислоты и 0,00001 М раствора гидроксида натрия.
Решение:
Электролиты HF и NaOH есть сильными и потому в растворе диссоциируют полностью.
Для указанных растворов имеем:
![]()
![]()
![]()
![]()
Ответ: 3 и 9.
312. Слили 30 г 2 %-ного раствора ацетата свинца Pb(CH3COO)2 и 50 мл 1 М раствора иодоводородной кислоты HI. Определите массу осадка иодида свинца.
Решение:
Уравнение реакции:
![]()
в уравнении ![]() .
.
Теперь рассчитаем какой реагент в избытке:
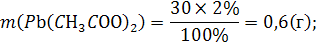
![]() =
=![]()
![]()
– находится в избытке, расчеты ведем по
![]() ; так как
; так как ![]() , то
, то
![]()
Ответ: ![]() .
.
337. В 70 г бензола С6Н6 растворено 2,09 г некоторого вещества. Раствор кристаллизуется при 4,250С. Установить молекулярную массу растворенного вещества. tкрист.бензола= 5,50С.
Решение:
Криоскопическая константа выражается формулой
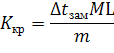
где Ккр – криоскопическая константа; ![]() – величина, получаемая опытным путем – понижение точки замерзания раствора, состоящего из т кг растворенного неэлектролита и L кг растворителя; М – масса 1 моль неэлектролита, кг. Криоскопическая константа бензола Ккр = 5,1°.
– величина, получаемая опытным путем – понижение точки замерзания раствора, состоящего из т кг растворенного неэлектролита и L кг растворителя; М – масса 1 моль неэлектролита, кг. Криоскопическая константа бензола Ккр = 5,1°.
Отсюда
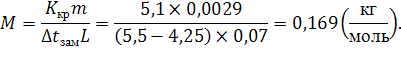
Ответ: ![]() .
.
Похожие работы
... , а в нейтральных и щелочных растворах ионы О реагируют с образованием гидроксид-ионов НОН + О = 2ОН . Применяются в основном два метода составления уравнений окислительно-восстановительных реакций: 1) электронного баланса – основан на определении общего количества электронов, перемещающихся от восстановителя к окислителю; 2) ионно-электронный – предусматривает раздельное ...
... электроны, понижает свою степень окисления, восстанавливается, а вещество Red2 с меньшим сродством к электрону (восстановитель) окисляется. Окисленная и восстановленная формы реагирующих в ОВР веществ образуют окислительно-восстановительные (оксред-, редокс-) пары ОХ1/Red1 и OX2/Red2, а превращения типа OX+ze - Red называют оксред - (редокс) - переходами или окислительно-восстановительными ...
... раствора; · присутствие катализатора. В большинстве случаев скорость реакции находится в прямой зависимости от температуры и рН раствора. Поэтому многие определения методом окислительно-восстановительного титрования следует проводить при определенном значении рН и при нагревании. Индикаторы окислительно-восстановительного титрования окислительный восстановительный титрование При анализе ...
... каротин, ксантофилл, ликопин, лютеин. Витамины имеют высокую физиологическую активность, сложное и разнообразное химическое строение. Они необходимы для нормального роста и развития организма. Витамины регулируют окисление углеводов, органических кислот, аминокислот, некоторые из которых входят в состав НАД, НАДФ. Биосинтез витаминов свойственен преимущественно зелёным растениям. В животных ...
0 комментариев