Навигация
Органолептичні, фізико-хімічні, санітарно-гігієнічні показники
1.2 Органолептичні, фізико-хімічні, санітарно-гігієнічні показники
На зовнішній вигляд Na2S2O3 – це безбарвні кристали, що не злежуються, гранули або білий кристалічний порошок. Можливий жовтуватий або слабо-рожевий відтінок. Кристалічна форма – моноклінна (а = 0,8513 нм, b = 0,8158 нм, с = 0,6425 нм, b = 97,08 °, z = 4). Тіосульфат натрію на повітрі стійкий до 800С, при нагріванні у вакуумі при 3000С розкладається на сульфіт натрію та сірку. Добре розчинний у воді ((г в 100 г): 50,1 (0°С), 70,2 (20 °С), 231,8 (80 °С)), проте нестійкий. При температурі 11 - 480С з води кристалізується у вигляді пентагідрату Na2S2O3·5Н2О. Окрім пентагідрату тіосульфату натрію, відомий декагідрат натрію, який має формулу Na2S2O3·10Н2О. Кристалогідрати іншої молекулярної формули не виявлені.
Молярна маса речовини : М(Na2S2O3) = 158,11 г/моль.
Молярна маса пентагідрату: М(Na2S2O3·5Н2О) = 248,17 г/моль.
Густина речовини 1,667 г/см3.
ΔH0обр (a) -1136 кДж/моль
Розчинність в 100г холодної води складає 66,7г, а в гарячій воді 266г. Тіосульфат натрію розчинний також в аміаку NH3, у водних розчинах SO2, слабо розчинний в спиртах (етанолі).
При 48,50С гіпосульфіт плавиться в своїй кристалізаційній воді, зневоднюється близько 1000С.
При введенні в організм тіосульфат натрію надає протизапальний, протитоксичний та десенсибілізуючий ефекти. Знешкоджує препарати йоду та виказують протипаразитну дію.
1.3 Методи одержання тіосульфату натрію
а) окисненням полісульфідів Na;
б) кип’ятіння надлишку сірки з Na2SO3:
S + Na2SO3 → Na2S2O3;
в) взаємодією H2S та SO2 з NaOH (побічний продукт при виробництві NaHSO3, сірчаних барвників, при очищенні промислових газів від S):
4SO2 + 2H2S + 6NaOH → 3Na2S2O3 + 5H2O;
г) кип’ятіння надлишку сірки з гідроксидом натрію:
3S + 6NaOH → 2Na2S + Na2SO3 + 3H2O,
потім за приведеною вище реакцією сульфіт натрію приєднує сірку, утворюючи тіосульфат натрію.
Одночасно в ході цієї реакції утворюються полісульфиди натрію (вони надають розчину жовтий колір). Для їх руйнування в розчин пропускають SO2.
д) чистий безводний тіосульфат натрію можна отримати реакцією сірки з нітритом натрію у формаміді. Ця реакція кількісно протікає (при 80°C за 30 хвилин) за рівнянням:
2NaNO2 + 2S → Na2S2O3 + N2O↑
е) розчинення сульфіду натрію у воді у присутності кисню повітря :
2Na2S + 2O2 + H2O = Na2S2O3 + 2NaOH
1.4 Хімічні властивості тіосульфату натрію
а) загальні хімічні властивості тіосульфату натрію
Тіосульфат натрію можна віднести до досить нестійких речовин. При нагріванні до 2200С розпадається відповідно до схеми:

В реакції термічного розкладу тіосульфату натрію отримують полісульфід натрію, котрий також далі розкладається на сульфід натрію та елементарну сірку.
Розчини тіосульфату натрію нестабільні через взаємодію з вуглекислим газом, що міститься в повітрі та розчинений у воді:
S2O32- + CO2 + H2O →HSO3- +S↓ + HCO3-
А також через окислення киснем повітря:
S2O32- + O2 →2SO42- +S↓
Тому готувати розчин тіосульфату натрію з наважки недоцільно, зазвичай готують розчин приблизної концентрації та встановлюють точну концентрацію титруванням розчином біхромату калію або розчином йоду.
При йодометричному титруванні застосовують метод зворотного титрування, так як додають надлишок розчину йодиду калію точної концентрації, а потім титрують йод, що утворився, розчином тіосульфату натрію, наприклад, при визначенні Fe3+:
2Fe3+ + 2I- →I2 + 2Fe2+
![]()
Оскільки йод навіть в слабкокислих розчинах містить гіпойодид-іони, що утворюються в результаті його гідролізу, які є більш сильними окисниками, ніж йод, і окислюють тіосульфати до сульфатів, помітно може проходити побічна реакція:
S2O32- + 4I2 +10OH- →2SO42- + 8I- + 5H2O
При збільшенні концентрації гідроксил-іонів збільшується кількість тіосульфату, який окислюється до сульфату. В сильно лужному середовищі ця реакція проходить кількісно, йодат-іони в ході реакції не утворюються.
Хоча реакція між йодом та тіосульфатом проходить швидко і якась кількість тетратіонату утворюється одразу після змішування, було доведено утворення безбарвної проміжної сполуки S2O3І- в результаті швидкої зворотної реакції
S2O32- + I3- ↔ S2O3І- + 2I-
Проміжна сполука вза’ємодіє з йодидом:
S2O3І- + I- → S4O62- + 2I3-,
Чим і пояснюється повторна поява йоду поблизу кінцевої точки при титруванні дуже розбавлених розчинів йоду.
Виділити тіосірчану кислоту Н2S2O3 реакцією тіосульфату натрію з сильною кислотою неможливо, так як вона нестійка і одразу розкладається:
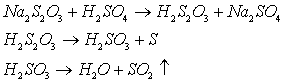
В таку ж реакцію буде вступати соляна та азотна кислоти. Розкладання супроводжується виділенням SO2, який має неприємний запах и подразнює слизові оболонки дихальних шляхів, що потребує обережності при роботі з ним.
б) Окисно-відновні властивості тіосульфату натрію
У зв’язку з наявністю атомів сірки зі ступенем окиснення 0 іон тіосульфату S2O32- має відновні властивості. Наприклад, слабкими окисниками (І2, Fe3+) тіосульфат окиснюється до іона тетратіоната:
![]()
Наведена реакція дуже важлива, так як є основою йодометрії.
Більш сильні окисники окислюють його до іона сульфату:
![]()
Слід також відмітити, що в лужному середовищі окиснення тіосульфату натрію йодом теж може проходити до сульфату.
Сильними відновниками іон S2O32- відновлюється до похідних S2-:
![]()
Як видно з наведених реакцій, в залежності від умов, тіосульфат натрію може проявляти як окисні, так і відновні властивості.
в) комплексоутворюючі властивості тіосульфатів
Тіосульфат-іон – сильний комплексоутворювач, що використовується в фотографії для видалення з фотоплівки невідновленого броміду срібла:
![]()
![]()
Слід відмітити, що металами S2O32- іон координується через атом сірки, тому тіосульфатні комплекси легко перетворюються у відповідні сульфіди, наприклад:
![]()
Існують тіосульфатні комплекси багатьох металів. В літературі [3,6] описано наявність близько 40 комплексних сполук з багатьма важкими металами. В [11] наведені константи нестійкості комплексних іонів, де комплексоутворюючим іоном виступають атоми срібла, барію, кальцію, кадмію, кобальту, міді, заліза, ртуті, марганцю, магнію, натрію, нікелю, свинцю, стронцію та цинку. Для багатьох важких металів такі комплексні сполуки є надзвичайно стійкими і з їх допомогою можна виводити важкі метали з організму при отруєннях.
У випадках, коли важкі метали не утворюють стійких комплексів, взаємодія з тіосульфат-іонами призводить спочатку до утворення відповідних тіосульфатів, які миттєво або при кип’ятінні виділяють сульфіди.
В таблиці 1.1. наведені значення деяких констант нестійкості комплексних іонів, які містять в своєму складі іон тіосульфату:
Таблиця 1.1 - Значення констант нестійкості комплексних іонів
| Формула іона | Константа | Формула іона | Константа |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Виходячи зі значень констант нестійкості комплексів можна зробити висновок, що найбільш стійкими будуть комплекси, які включають іони двовалентної ртуті, що можна використовувати при отруєннях нею.
Похожие работы
... є продуктивність праці. Так трудомісткість виготовлення 1000 дал технічних рідин на підприємстві становить 490 годин. 2.2 Аналіз організації процесу оцінювання та методи контролю якості на ДП ”Лужанський експериментальний завод” На ДП ”Лужанський експериментальний завод” використовуються наступні методи контролю: Відбирання проб Під час наливання цистерни з крана, встановленого на нагні ...
0 комментариев