Навигация
Дипептидазы (дипептидгидролазы) катализируют гидролитическое расщепление на свободные аминокислоты
3. дипептидазы (дипептидгидролазы) катализируют гидролитическое расщепление на свободные аминокислоты.
NH2CH2CONHCH2COOH + H2O 2CH2NH2COOH
глицил-глицин гликолол
Дипептидазы расщепляют только такие пептидные связи, по соседству с которыми находятся одновременно свободные карбоксильная и аминная группы. Большое влияние на действие дипептидаз оказывает наличие -водородных атомов, находящихся у атомов углерода, связанных со свободной карбоксильной и аминной группами. При замене этих атомов другими группировками активность ферментов снижается или совсем исчезает.
4. протеиназы - (пептидилгидролазы) гидролизуют непосредственно белок. При этом образуются полипептиды и свободные аминокислоты. К этой подгруппе протеиназ принадлежит пепсин, трипсин, химотрипсин, папаин и др. В процессе действия ферментов на субстраты решающую роль играет структура молекул субстрата (соответствующая часть молекулы субстрата), в которой происходит разрыв. Характер распада белковой молекулы на пептиды и аминокислоты зависит от природы субстрата и внешних условий (рН, температуры и др.). В качестве белковых субстратов используют желатин, гемоглобин, казеин, сывороточный альбумин.
Методы определения активности протеолитических ферментов
Модификационный метод. Модификационный метод с применением субстрата казеина основан на определении скорости ферментативной реакции гидролиза субстрата под действием исследуемых протеолитических ферментов, содержащихся в материале, взятом на анализ. Скорость реакции определяют по количеству образовавшихся аминокислот - тирозина (a-амино-b-оксифенилпропионовая кислота) и триптофана (a-амино-b-индолилпропионовая кислота), которые устанавливают колориметрической реакцией с реактивом Фолина. Этим методом определяют указанные аминокислоты как в свободном, так и в связанном состоянии.
По количеству тирозина и триптофана, содержащемуся в гидролизате, определяют количество превращенного белка в процессе ферментативной реакции (из расчета содержания в белке 6% тирозина и 1.8% триптофана). В основу расчета активности протеолитических ферментов положена зависимость степени гидролиза белка от числа единиц активности фермента, введенных в ферментативную реакцию. На основе этой зависимости составляется график.
Поскольку в данном методе количество аминокислот, характеризующих количество превращаемого белка, определяется по интенсивности окраски реакционных сред - оптической плотности после реакции с реактивом, то в графике для простоты расчета вместо количества превращенного белка ставится пропорциональная ему оптическая плотность раствора. При составлении графика по оси абсцисс откладывают число единиц фермента, введенное в ферментативную реакцию, а по оси ординат - оптическую плотность, полученную после колориметрической реакции с реактивом Фолина.
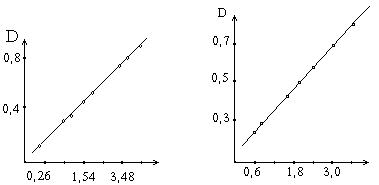
Содержание белка,мг Единицы активности
Зависимость оптической плотности от количества превращенного в процессе ферментативной реакции белка.
Зависимость оптической плотности от числа единиц активности протеолитических ферментов.
Относя количество введенных в реакцию единиц активности фермента к действию 1 г препарата, определяют его активность. Для расчета прямой, изображенной на графике, составляет расчетное уравнение.
За единицу протеолитической активности принято такое количество фермента, которое катализирует за 30 минут гидролиз 1 г белка в принятых условиях до продуктов, не осаждающихся трихлоруксусной кислотой. 1г составляет 25% от взятого на ферментативную реакцию белка.
Протеолитическая активность характеризуется числом единиц активности фермента, содержащегося в 1 г препарата и твердых полупродуктов или в 100 мл жидких материалов. Метод предназначен для анализа очищенных ферментных препаратов грибного происхождения и всех полупродуктов, получающихся при их производстве.
Определение пепсина по Ансону и Мирскому. Данный метод основан на следующих принципах. Гемоглобин подвергают воздействию пепсина, оставшийся гемоглобин осаждают трихлоруксусной кислотой. Фенольные свойства остатка (тирозин), определяемые фотометрически, используют как меру активности фермента.
Субстратом служит 2%-ный раствор гемоглобина в 0.06 н. растворе соляной кислоты, 5 мл субстрата нагревают до 250С, прибавляют 1 мл раствора фермента, оставляют в течении 10 мин., добавляют 10 мл 0.3 н. раствора трихлоруксусной кислоты, энергично взбалтывают, фильтруют и 5 мл фильтрата отливают в мерную колбу на 25 мл. Сюда же приливают 10 мл 0.5 н. раствора едкого натра и 3 мл фенольного реактива (реактив Фолина-Чиокалтеу разводят предварительно двойным объемом воды) и доводят водой до метки. По истечении нескольких минут окрашенный раствор фотометрируют относительно стандартного раствора, содержащего 0.0008 мэкв тирозина в 5 мл 0.2 н. раствора соляной кислоты (к раствору добавляют 0.5% формальдегида в качестве антисептика). Для исключения возможных ошибок ставят холостой опыт. Единицы пепсина выражают в миллиэквивалентах тирозина (в пределах от 6.10-4 до 11.10-4): единицы пепсина = миллиэквиваленты тирозина х1.47.
Определение протеолитических ферментов по Муру и Штейну. Метод основан на том, что содержащие a-аминогруппу аминокислоты дают с нингидридом окрашенную производную - дикетогидриндилидендикетогидриндамин, а также альдегид-аминокислоты и углекислоту.
Окрашенный продукт обладает характерным максимумом поглощения при 570 мm, а интенсивность окраски зависит от количества аминокислоты. С пролином и оксипиролином реакция протекает в ином направлении, а максимум поглощения получаемого при этом окрашенного продукта расположен при 440 мm.
Инкубацию фермента удобно проводить в мерных колбочках по 5 мл, в которых смешивают и уравновешивают при постоянной температуре на водяной бане все компоненты за исключением фермента. После этого добавляют фермент, раствор смешивают и берут пробы для исследования. Для кинетических измерений концентрацию фермента желательно подобрать таким образом, чтобы аликвотные части можно было бы брать каждые 5 минут.
Аликвотные части пробы, взятые сразу же после добавления фермента, а затем через соответствующие интервалы, добавляют в фотометрические пробирки, содержащие 2 мл реактива нингидрида - это тотчас обрывает реакцию. После этого смесь 20 мин. нагревают на водяной бане; полученная окраска устойчива минимум 24 часа. Средняя ошибка при анализе повторных проб составляет ±2%. После разбавления кипяченой смеси пробы и нингидрида 10 мл смеси, состоящей из равных объемов воды и н.пропанола, интенсивность окраски определяют на спектрофотометре Колемана при 570 мm.
Для калибровки пользуются постоянными количествами стандартных аминокислот, содержащих реакционные компоненты. При помощи калибровочных кривых, построенных отдельно для каждой исследуемой аминокислоты, измерения интенсивности окраски (по отношению к контрольной колбе) пересчитывают в миллимоли. При делении этих величин на миллимоли субстрата, использованного в процессе реакции, можно найти процент гидролиза.
Построение калибровочной кривой исключает ошибки, происходящие от качественных различий реакции аминокислот на цветной реактив. До оптической плотности 0.1 зависимость между величиной поглощения и количеством субстрата носит линейный характер.
Воспроизводимость составляет ±3%. Мешающее влияние аммония, аминов и других веществ, содержащихся в биологическом материале и дающих цветную реакцию с нингидридом, исключается при помощи соответствующих холостых проб. Анализ сравнительно упрощается, когда изучают протеолитические ферменты, субстратами которых являются пептиды, не содержащие свободных аминогрупп. В этом случае вся образующаяся окраска целиком приходится на освободившуюся аминокислоту.
Микрометод определения активности протеиназ А.П.Алексеенко. Предлагаемый микрометод определения активности протеолитических ферментов основан на измерении содержания аргинина в пептидах, освобождающихся при гидролизе протеиназами белковых субстратов. Содержание аргинина определяют с помощью стабилизированной и усовершенствованной реакции Сакагучи (хроматограмму погружают в 0.1% раствор 8-гидроксихинолина в ацетоне, высушивают на воздухе, опрыскивают раствором 0.2 мл Br2 в 100 мл 0.5 М NaOH; аргинин и другие гуанидины дают оранжево-красные пятна, тауромицин и гликоциамин - лишь временную окраску), позволяющей определить содержание аргинина в растворах трихлоруксусной кислоты после осаждения и удаления нерастворимых белков. Зная содержание аргинина в белковом субстрате и определяя его количество в перешедших в раствор пептидах, можно рассчитать процент гидролиза белкового субстрата изучаемыми протеиназами. В этом состоит главное преимущество метода, поскольку метод Ансона не дает возможности рассчитать процент гидролиза белка, атакуемого протеолитическими ферментами. Из всех существующих методов только метод Мура и Штейна позволяет определить процент гидролиза белковых субстратов, но он имеет ограниченное применение, поскольку требует предварительного проведения полного кислотного гидролиза как белка-субстрата, так и образовавшихся пептидов. В предложенной методике калибровочная кривая строится по растворам свободного аргинина. Введение в реакцию пептидов и белков в виде их биуретовых комплексов повысило чувствительность реакции Сакагучи с остатками аргинина и сделало ее такой же чувствительной, как и для свободного аргинина. В качестве белкового субстрата используют классический субстрат - гемоглобин и окисленный по Сангеру лизоцим. Этот низкомолекулярный белок, содержащий 12.7% аргинина прекрасно расщепляется пепсином (рвется около 30 связей).
Прежде чем приступить к определению активности ферментов в изучаемых тканевых субстратах, необходимо:
Похожие работы
... эффект ?-сон индуцирующего пептида при гипокинетическом стрессе // Укр.биохим.-1991.-63.-№1.-С.34-37. 118.Механизмы развития стресса // Сб.статей.- Кишинев: Штиинца.- 1987.-222с. 119.Митюшина Н.В. Влияние энкефалинов на активность ферментов обмена регуляторных пептидов в головном мозге и периферических тканях крыс // дис. на соиск. степени.канд.биол.наук.- Пенза.-1999 120.Наркевич В.Б. ...
... реакция подчинена закону действующих масс и рассматривается в свете теории Михаэлиса – Ментона, то есть V=K(F) V- скорость реакции K- константа скорости F- концентрация фермента (Смотри приложение 4). На графике показано соотношение скорости реакции и концентрации субстрата. В восходящей части гиперболы при низких концентрациях ...
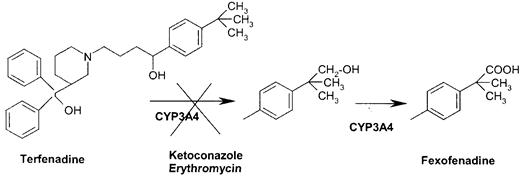
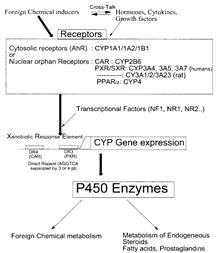
... гем- содержащих монооксигеназ цитохрома P 450, с которыми связываются, подверженные окислительному метаболизму ксенобиотики. [Clin. Pharmcokinet 38, 493, 2000]. Таблица 6 - Механизмы индукции различных изоформ цитохрома Р-450 Механизм индукции Индукция и регуляция P450 Транскрипця генов посредством рецепторов 1A1 (цитозоль AhR), 1A2, 1B1 2A6, 2B6 (CAR), 2C8, 2C9, 2C18, 2C19 3A4, 3A5 ...
... явилось логическим развитием общего биологического учения о ферментах. К настоящему времени получены убедительные доказательства, что современная биология и медицина говорят на языке энзимологии и что возможности применения ферментов в медицине теоретически безграничны [1, 2]. В частности, четко определились три основных направления исследований в области медицинской энзимологии: энзимопатология, ...
0 комментариев