Навигация
СЕКВЕНИРОВАНИЕ ДНК МЕТОДОМ ПОЛИМЕРАЗНОГО КОПИРОВАНИЯ
2. СЕКВЕНИРОВАНИЕ ДНК МЕТОДОМ ПОЛИМЕРАЗНОГО КОПИРОВАНИЯ.
(МЕТОД СЭНГЕРА)
Ферментативный синтез олиго(поли)дезоксирибонуклеотидов с помощью ДНК-полимераз, заключающийся в копировании матричного полинуклеотида нашел блестящее применение в качестве одного из двух наиболее эффективных методов установления первичной структуры ДНК. Метод состоит в получении блоков-копий полидезоксирибонуклеотида, структура которого изучается. При этом обязательным является выполнение двух условий. Во-первых, копирование должно проводиться, начиная с определенного мономерного звена. Во-вторых, синтез копий следует осуществлять четыре раза, каждый раз останавливая его поочередно на каком-либо одном из четырех мономёрных звеньев (A, G, С или Т), иначе говоря, стремятся получить полный набор "комплементационно отраженных" копий исследуемого полинуклеотида, образование которых прекратилось в каждом из мест расположения одного из четырех мономерных звеньев нуклеиновой кислоты. Определение длины каждой копии позволяет установить положение данного мономерного звена в цепи исследуемого полинуклеотида. Длина копии определяется фракционированием в полиакриламидном геле. Этот метод, таким образом, так же как и метод, основанный на модификации оснований позволяет получать информацию о положении определенного мономерного звена в цепи полинуклеотида прямо после фракционирования.
Для получения копии исследуемого полинуклеотида в последнем выбирают точку отсчета, что достигается введением в систему ферментативного синтеза в качестве нуклеозидного компонента олигонуклеотида-затравки. Такой олигонуклеотид во всех копиях, образующихся в результате достраивания его ферментативным путем, остается постоянным 5'-концевым фрагментом, т. е. является точкой отсчета. Копирование с помощью ДНК-полимеразы в присутствии всех четырех дезоксирибонуклеозид-5'-пирофосфатов (один из них берется ![]() 32Р-меченным) проводят в течение ограниченного времени. Цель этого этапа - проведение статистически ограниченного синтеза для получения всех возможных копий, начиная с затравки, достроенной на одно, два и т. д. звеньев, и включая полную копию изучаемого полинуклеотида. В идеале смесь должна включать все возможные полинуклеотиды (рис. 5), синтез которых статистически прекращается где-то в середине матричного полинуклеотида в районе ATGCTG матричной последовательности. На практике различные компоненты смеси присутствуют в разных количествах. Если такую смесь далее подвергнуть электрофорезу в полиакриламидном геле в определенных условиях, когда скорость движения пропорциональна длине цепи, на электрофореграмме обнаруживается серия полос, представляющих различные олигонуклеотиды. Такое фракционирование обычно не
проводят, хотя оно может использоваться для контроля на
32Р-меченным) проводят в течение ограниченного времени. Цель этого этапа - проведение статистически ограниченного синтеза для получения всех возможных копий, начиная с затравки, достроенной на одно, два и т. д. звеньев, и включая полную копию изучаемого полинуклеотида. В идеале смесь должна включать все возможные полинуклеотиды (рис. 5), синтез которых статистически прекращается где-то в середине матричного полинуклеотида в районе ATGCTG матричной последовательности. На практике различные компоненты смеси присутствуют в разных количествах. Если такую смесь далее подвергнуть электрофорезу в полиакриламидном геле в определенных условиях, когда скорость движения пропорциональна длине цепи, на электрофореграмме обнаруживается серия полос, представляющих различные олигонуклеотиды. Такое фракционирование обычно не
проводят, хотя оно может использоваться для контроля на
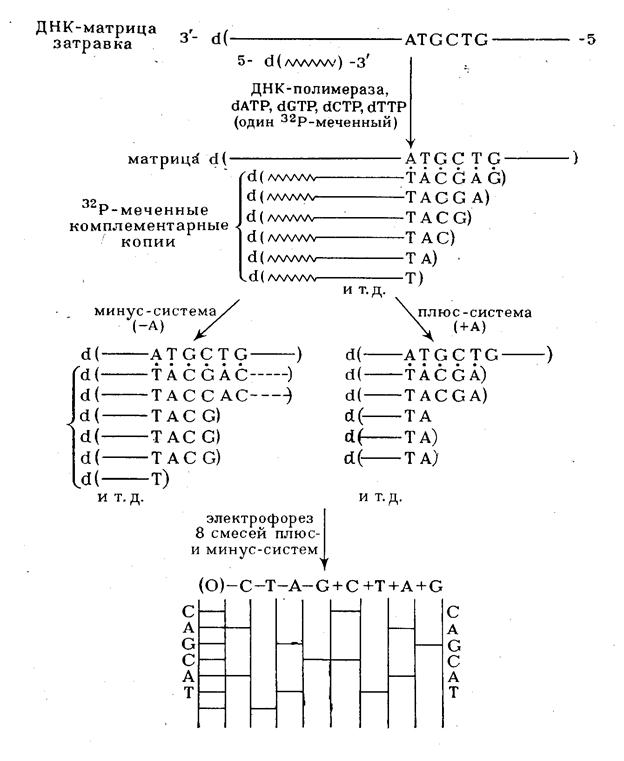
Рисунок 5 Использование ферментативного синтеза олиго(поли)дезоксирибонуклеотидов для определения первичной структуры ДНК.
завершающем этапе анализа. Инкубационную смесь 32Р-меченных олигонуклеотидов различной длины в виде комплексов с матричным полинуклеотидом подвергают гель-фильтрации для удаления дезоксирибонуклеозид-5'-трифосфатов и аликвоты реакционной смеси реинкубируют с ДНК-полимеразой в различных условиях. В случае "минус-системы" реинкубацию проводят в присутствии только трех дезоксирибонуклеозид-5'-три-фосфатов. Например, в «- А-системе» отсутствует dATP и каждая копия в смеси достраивается с помощью ДНК-полимеразы до места, в котором следующим мономерным звеном должен быть остаток pdA (т.е. Т в матричном полинуклеотиде). Образующуюся смесь фракционируют с помощью электрофореза и обнаруживают (ауторадиографически) ограниченное количество полос (их количество равно количеству Т в матричном полинуклеотиде). Аналогично проводят копирование в отсутствие других субстратов: - dGTP, - dCTP или - dTTP (- G-,- С- и - Т-системы соответственно). Все четыре ионофореза проводят в полиакриламидном геле параллельно. Полученные ауторадиограммы позволяют сразу написать нуклеотидную последовательность, причем чтение цепи снизу вверх соответствует 5'![]() 3'-полярности цепи копии. Например, положение самого короткого олигонуклеотида (в " - Т-системе") указывает на то, что следующий за ним по длине олигонуклеотид заканчивается на Т, т. е. что против полосы, расположенной выше (это полоса в
- А-системе), следует записать букву Т. Таким же образом записывают далее в последовательности букву А (на основании положения следующего по длине олигонуклеотида, который оказался в "- А-системе") и т. д. Соответствующий участок цепи в матрице читается с учетом принципа комплементарности и антипараллельности цепей в комплексе матрица - затравка. Для проверки этих данных используют результаты анализа с помощью "плюс-системы". В этом случае дополнительное копирование (после первого этапа) проводят в присутствии ДНК-полимеразы, выделенной из бактериофага Т4, которая в отсутствие субстратов (нуклеозид-5'-трифосфатов) проявляет 3'-экзонуклеазную активность (аналогичную действию ФДЭ змеиного яда), т. е. отщепляет мононуклеотиды один за другим с 3'-конца. В то же время в присутствии субстратов ее полимеразная активность во много раз превосходит экзонуклеазную. Так, если в реакционной смеси присутствует хотя бы один дезоксирибонуклеозид-5'-трифосфат (dATP в " +А-системе"), деградация каждой копии, образовавшейся на первой стадии анализа, будет проходить вплоть до места положения А (Т в матрице). В этом случае pdA включается много быстрее, чем удаляется, и, таким образом, накапливаются фрагменты, содержащие на 3'-конце цепи А. Аналогично проводят копирование в присутствии только dGTP, dCTP или dTTP. Смеси параллельно подвергают электрофорезу, как и в предыдущем случае, и получают ауторадиограммы, из которых сразу считывается последовательность 5'
3'-полярности цепи копии. Например, положение самого короткого олигонуклеотида (в " - Т-системе") указывает на то, что следующий за ним по длине олигонуклеотид заканчивается на Т, т. е. что против полосы, расположенной выше (это полоса в
- А-системе), следует записать букву Т. Таким же образом записывают далее в последовательности букву А (на основании положения следующего по длине олигонуклеотида, который оказался в "- А-системе") и т. д. Соответствующий участок цепи в матрице читается с учетом принципа комплементарности и антипараллельности цепей в комплексе матрица - затравка. Для проверки этих данных используют результаты анализа с помощью "плюс-системы". В этом случае дополнительное копирование (после первого этапа) проводят в присутствии ДНК-полимеразы, выделенной из бактериофага Т4, которая в отсутствие субстратов (нуклеозид-5'-трифосфатов) проявляет 3'-экзонуклеазную активность (аналогичную действию ФДЭ змеиного яда), т. е. отщепляет мононуклеотиды один за другим с 3'-конца. В то же время в присутствии субстратов ее полимеразная активность во много раз превосходит экзонуклеазную. Так, если в реакционной смеси присутствует хотя бы один дезоксирибонуклеозид-5'-трифосфат (dATP в " +А-системе"), деградация каждой копии, образовавшейся на первой стадии анализа, будет проходить вплоть до места положения А (Т в матрице). В этом случае pdA включается много быстрее, чем удаляется, и, таким образом, накапливаются фрагменты, содержащие на 3'-конце цепи А. Аналогично проводят копирование в присутствии только dGTP, dCTP или dTTP. Смеси параллельно подвергают электрофорезу, как и в предыдущем случае, и получают ауторадиограммы, из которых сразу считывается последовательность 5'![]() 3'-направление, считывается также снизу вверх). Из сравнения фореграмм "плюс-" и "минус-систем" делается однозначный вывод о нуклеотидной последовательности в копиях и, следовательно, в матричном полинуклеотиде.
3'-направление, считывается также снизу вверх). Из сравнения фореграмм "плюс-" и "минус-систем" делается однозначный вывод о нуклеотидной последовательности в копиях и, следовательно, в матричном полинуклеотиде.
В настоящее время выделение фрагментов ДНК, создание рекомбинантных генов, а так же прямое секвенирование ДНК и кДНК становятся общедоступными методами благодаря широкому внедрению ПЦР (полимеразной цепной реакции).Сущность ПЦР заключается в использовании двух олигонуклеотидов-праймеров, способных специфически гибридизоваться с последовательностями нуклеотидов на противоположных концах двух цепей участка ДНК, в качестве затравки для одновременного синтеза комплементарных цепей с противоположных концов матрицы с помощью термостабильной ДНК-полимеразы. В ходе повторяющихся циклов (температурной денатурации ДНК, отжига и энзиматической достройки праймеров) экспоненциально увеличивается количество дискретного фрагмента, фланкированного последовательностями нуклеотидов, соответсвующих первичной структуре праймеров.
Применимость метода Сэнгера зависит от возможности получения одноцепочечных копий клонированных ДНК. Для этой цели можно использовать векторы на основе бактериофага М13. Двухцепочечную чужеродную ДНК можно клонировать в двухцепочечной репликативной форме (РФ) фаговой ДНК, при этом после трансформации в белковую оболочку будет упаковываться только одна из цепей ДНК. Во всех векторах типа М13тр используются сходные полилинкерные последовательности, поэтому для инициации полимеразных реакций пригоден один и тот же универсальный праймер. При амплификации смеси генов (например, семейства генов) необходимо провести клонирование ПЦР-продуктов в векторах типа М13, в результате каждый фаг будет содержать только одну вставку. При прямом секвенировании смеси генов наблюдается несколько одинаково расположенных полос в разных дорожках геля. При амплификации же одного гена можно проводить прямое секвенирование, не прибегая к промежуточному субклонированию.
Выбор оптимального праймера для ПЦР зависит от 5 '- и 3 '-концевых последовательностей амплифицируемого фрагмента ДНК. Кроме того, для встраивания ПЦР-продукта в полилинкерный сайт вектора М13 в 5'-конец праймеров должны быть включены подходящие рестрикционные сайты. В этом случае ПЦР-амплификация с последующей рестрикцией продукта позволит провести его встраивание в ДНК М13, рестрицированную тем же ферментом. В разные концы амплифицируемого фрагмента лучше включать сайты для разных рестриктаз, поскольку это позволит избежать отжига векторной ДНК самой на себя и обеспечит положение клонированной вставки в определенной ориентации (так называемое направленное клонирование). При подборе праймеров необходимо учитывать следующие факторы.
а. Следует убедиться в том, что амплифицируемое семейство генов не содержит консервативного внутреннего рестрикционного сайта, идентичного сайту, включенному в праймер.
б. После включения рестрикционного сайта 5' - конец праймера нужно удлинить, в противном случае рестриктаза не будет расщеплять праймер. Необходимая для каждого фермента длина выступающего участка и время рестрикции указаны в каталоге фирмы New England BioLabs.
Перед секвенированием двухцепочечную рекомбинантную ДНК М13 необходимо перевести в одноцепочечную форму. Для этого ее вводят путем трансформации в компетентные клетки E. сoli. Бляшки, содержащие одноцепочечные рекомбинантные фаги, необходимо выколоть, нарастить в бактериальной культуре и депротеинизировать.
Затем переносят культуру в микроцентрифужную пробирку на 1,5 мл и центрифугируют в микроцентрифуге при 12 000 g в течение 5 минут. Переносят 1 мл супернатанта (содержащего чистый фаг) во вторую пробирку на 1,5 мл, добавляют 200 мкл полиэтиленгликоля и инкубируют при комнатной температуре как минимум 15 минут. Собирают фаг центрифугированием в течении 5 минут при 12 000 g и отбирают супернатант. Быстро повторяют центрифугирование и полностью удаляют все следы супернатанта. Затем осаждают ДНК ацетатом натрия, промывают ее 70%-ным этанолом и высушивают под вакуумом. Растворяют ДНК в 30 мкл воды. Полученная ДНК представляет собой одноцепочечную матрицу для секвенирования.
Ниже приведена конкретная методика секвенирования:
Материалы
• 5 х реакционный буфер: 200 мМ трис-HCl, рН 7,5, 100 мМ MgCl2, 250 мМ NaCl
• Буфер для разведения фермента: 10 мМ трис-HCl, рН 7,5, 5 мМ ДТТ, 0,5 мг/мл БСА
• 5 х смесь для мечения: по 7,5 мкМ dGTP, dCTP, dTTP
• Смесь для ddG-терминации: по 80 мкМ dGTP, dATP, dCTP, dTTP, 8 мкМ ddGTP, 50 мМ NaCl
• Смесь для ddA-терминации: по 80 мкМ dGTP, dATP, dCTP, dTTP, 8 мкМ ddATP, 50 мМ NaCl
• Смесь для ddC-терминации: по 80 мкМ dGTP, dATP, dCTP, dTTP, 8 мкМ ddCTP, 50 мМ NaCl
• Смесь для ddT-терминации: по 80 мкМ dGTP, dATP, dCTP, dTTP, 8 мкМ ddTTP, 50 мМ NaCl
• Стоп-раствор: 90% формамид, 20 мМ ЭДТА, 0,05% бромфеноловый синий, 0,05% ксилолцианол
• Универсальный праймер для секвенирования - 40 (0,5 пмоль/ мкл)
• [35S]dATP![]() S (1 мКи/37 МБк в 100 мкл) (Amersham, UK; в состав набора не входит)
S (1 мКи/37 МБк в 100 мкл) (Amersham, UK; в состав набора не входит)
• 0,1 М ДТТ
МетодикаВсе реактивы добавляют с помощью диспенсера на 2 мкл Hamilton (PB600), соединенного с адаптером и шприцом 1710 с газовым затвором. Смесь для мечения предварительно разбавляют в пять раз.
1. Для каждой секвенируемой матрицы смешивают в микроцен-трифужной пробирке на 1,5 мл для получения праймерной смеси 6 мкл воды, 1 мкл универсального праймера и 2 мкл реакционного буфера.
2. Размечают микроплашку Falcon 3911. В верхней ее части наносят номера клонов, а слева, сверху вниз, — буквы TCGA.
3. На дно каждой ячейки наносят 2 мкл праймерной смеси, на боковые стенки — по 2 мкл раствора секвенируемой матрицы и центрифугируют плашку. Накрывают ее пленкой Saran® и крышкой и помещают в водяную баню с температурой 70°С на 5 мин. Охлаждают плашку на столе (за это время происходит отжиг праймера и ДНК М13).
4. Пока плашка охлаждается, готовят смесь для мечения. Для этого в микроцентрифужную пробирку на 1,5 мл вносят 0,5 мкл 35S-dATP, 1 мкл 0,1 М ДТТ, 2 мкл разведенной смеси для мечения и 3,5 мкл воды.
5. Размечают поликарбонатную микроплашку Techne 96® так же, как первую плашку, и в ячейки в ряду "Т" вносят по 2 мкл смеси для ddT-терминации. Аналогичным образом вносят смесь для терминации в ячейки остальных рядов и помещают плашку в термостат для микроплашек с температурой 42°С.
6. После охлаждения плашки (п. 3) в течение 30 мин добавляют к смеси для мечения (для каждой матрицы) последовательно 1,77 мкл буфера для разведения фермента и 0,22 мкл фермента Sequenase® II. (Это позволяет держать фермент Sequenase® II вне холодильника минимальное время.)
7. По 2 мкл этой смеси наносят на боковую стенку ячеек, содержащих праймерную смесь, и центрифугируют плашку для перемешивания компонентов. Включают секундомер.
8. Через 2 мин начинают переносить раствор из ячеек первой плашки в соответствующие ячейки предварительно нагретой и помещенной в термостат поликарбонатной плашки. Для этого используют обычную микропипетку, быстро меняя наконечники после каждой ячейки (помните, что использованные наконечники радиоактивны).
Похожие работы
... генно-инженерных исследований. Многие из этих вопросов были подняты самими учеными активно работающих в данной области. В настоящее время большинство исследователей считали, что опасения касающиеся, генной инженерии, не имеют достаточно оснований, но многие этические проблемы остаются нерешенными и продолжают возникать новые. В прошлом генетика и медицинская генетика развивалась как относительно ...
... олигонуклеотидов—одну полуавтоматическую, а вторую в комплексе с компьютером. В 1982 г. цена этих приборов на американском рынке составляла 36000—39500 долл.[2]. К открытиям связанным с достижениями генной инженерии нужно прибавить то, что огромный генетический «чертеж» многоклеточного существа просчитан полностью. Я думаю это можно назвать достижением века. После восьми лет работы многих ...
... гистон), и от мыши. Вскоре аналогичная работа была выполнена в нашей стране группой специалистов под руководством С. И. Алиханяна и А. А. Баева. Достижения генетики и химии нуклеиновых кислот позволили разработать методологию генной инженерии: —открытие явления рестрикции — модификации ДНК и выделение ферментов рестриктаз для получения специфических ферментов; —создание методов химического ...
... через дыхательные пути человека). Воздушно- капельным путем (за счет образования стойких аэрозолей) распространяются многие респираторные инфекции (грипп, коклюш, дифтерия, корь, туберкулез и др.). Микробиологическая чистота воздуха имеет большое значение в больничных условиях (особо- операционные и другие хирургические отделения). Микрофлора человека и ее значение. Ребенок развивается в ...
0 комментариев