Навигация
Метод осадительного титрования. Практическое применение метода
Курская Государственная сельхоз Академия
Выполнила Лопина Елена
.
План
1.Сущность осадительного титрования.
2.Аргентометрическое титрование.
3.Тиоцианатометрическое титрование.
4. Применение осадительного титрования :
а) приготовление стандартизированного раствора нитрата серебра.
б) приготовление стандартизированного раствора тиоцианата аммония.
в) определение содержания хлора в образце по Фольгарду.
г) определение содержания трихлорацетата натрия в техническом препарате
1. Сущность осадительного титровани
Метод объединяет титриметрические определения, основанные на реакциях образования осадков малорастворимых соединений. В этих целях пригодны только некоторые реакции, удовлетворяющие определенным условиям. Реакция должна протекать строго по уравнению и без побочных процессов. Образующийся осадок должен быть практически нерастворимым и выпадать достаточно-быстро, без образования пересыщенных растворов. К тому же необходимо иметь возможность определять конечную точку титрования с помощью индикатора. Наконец, явления адсорбции (соосаждения) должны быть выражены при титровании настолько слабо,, чтобы результат определения не искажался.
Наименования отдельных методов осаждения происходят от названий применяемых растворов. Метод, использующий раствор нитрата серебра, называют аргентометрией. Этим методом определяют содержание ионов С1~ и Вг~ в нейтральных или слабощелочных средах. Тиоцианатометрия основана на применении раствора тиоцианата аммония NH4SCN (или калия KSCN) и служит для определения следов С1- и Вг~, но уже в сильнощелочных и кислых растворах. Используют ее и для определения содержания серебра в рудах или сплавах.
Дорогостоящий аргентометрический метод определения галогенов постепенно вытесняется меркурометрическим. В последнем используют раствор нитрата ртути (I) Hg2(NO3)2.
Рассмотрим более подробно аргентометрическое и тиоцианатометрическое титрование.
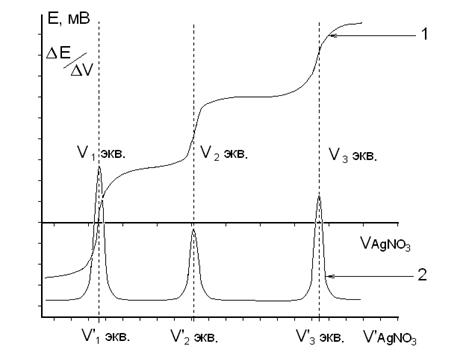
2. Аргентометрическое титрование 1
Метод основан на реакции осаждения ионов С1~ и Вг~ катионами серебра с образованием малорастворимых галогенидов: Cl-+Ag+=AgClb Br^- + Ag+= AgBr |
При этом используют раствор нитрата серебра. Если же анализируют вещество на содержание серебра, то пользуются раствором хлорида натрия (или калия).
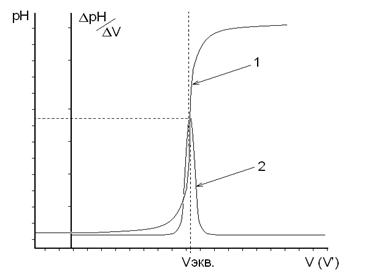
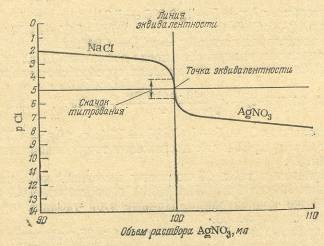
Для понимания метода аргентометрии большое значение имеют кривые титрования. В качестве примера рассмотрим случай титрования 10,00 мл 0,1 н. раствора хлорида натрия 0,1 н. раствором нитрита серебра (без учета изменения объема раствора).
До начала титрования концентрации хлорид-ионов в растворе равна общей концентрации хлорида натрия, т. е. 0,1 моль/л или [Cl-J^lO-1.
Обозначив отрицательный логарифм концентрации (или активности) определяемых хлорид-ионов через рС1, можно написать:
р ci = — lg [C1-] = —lg lO-i = 1.
Когда к титруемому раствору хлорида натрия будет прибавлено 9,00 мл раствора нитрата серебра и 90% хлорид-ионов будут осаждены, концентрация их в растворе уменьшится в 10 раз и станет равна Ы0~2 моль/л, а рС1 будет равен 2. Поскольку же величина nPAgci= IQ-10, концентрация ионов серебра при этом составит:
[Ag+] = 10-ю/[С1-] = Ю-Ю/10-2 = 10-8 Моль/л, ИЛИ pAg= — lg[Ag+] = — IglO-s = 8.
Аналогичным образом вычисляют все остальные точки для построения кривой титрования. В точке эквивалентности pCl=pAg= = 5 (см. табл.).
Таблица . Изменение рС\ и pAg при титровании 10,00 мл 0,1 н. раствора хлорида натрия 0,1 н. раствором нитрата серебра
| Прибавлено раствора AgNO3, '«V. МЛ
| [С1-]
| [Ag+]
| рС\
| Ms
|
| 0
| Ю-1
|
| 1
|
|
| 9,00 9,90
| ю-2 ю-3
| ю-8 ю-7
| 2 3
| 8 7
|
| 9,99 10,00 (точка экв.) 10,01
| ю-4 ю-5 ю-6.
| ю-6 ю-5 ю-*
| 4 5 6
| 6 5 4
|
| 10,10
| ю-7
| ю-3
| 7
| Q
|
| 11,00 20,00
| ю-8 ю-9
| ю-2 ю-1
| 8 9
| 2
|
Интервал скачка при аргентометрическом титровании зависит
от концентрации растворов и от значения произведения растворимости осадка. Чем меньше величина ПР получающегося в результате титрования соединения, тем шире интервал скачка на кривой титрования и тем легче фиксировать конечную точку титрования с помощью индикатора.
Наиболее распространено аргентометрическое определение хлора по методу Мора. Сущность его состоит в прямом титровании жидкости раствором нитрата серебра с индикатором хроматом калия до побурения белого осадка.
Индикатор метода Мора — раствор К2СгО4 дает с нитратом серебра красный осадок хромата серебра Ag2CrO4, но растворимость осадка (0,65-10~4Э/л) гораздо больше растворимости хлорида серебра (1.25Х _Х10~5 Э/л). Поэтому при титровании раствором нитрата серебра в присутствии хромата калия красный осадок хромата серебра появляется лишь после добавления избытка ионов Ag+, когда все хлорид-ионы уже осаждены. При этом всегда к анализируемой жидкости приливают раствор нитрата серебра, а не наоборот.
Возможности применения аргентометрии довольно ограничены. Ее используют только при титровании нейтральных или слабощелочных растворов (рН от 7 до 10). В кислой среде осадок хромата серебра растворяется.
В сильнощелочных растворах нитрат серебра разлагается с выделением нерастворимого оксида Ag2O. Метод непригоден и для анализа растворов, содержащих ион NH^", так как при этом образуется с катионом Ag+ аммиачный комплекс [Ag(NH3h]+- Анализируемый раствор не должен содержать Ва2+, Sr2+, Pb2+, Bi2+ и других ионов, дающих осадки с хроматом калия. Тем не менее аргентометрия удобна при анализе бесцветных растворов, содержащих С1~ и Вг_-ионы..
Растворы, содержащие Ag+, не выливают в раковину, а собирают в специальную склянку, так как серебро из них регенерируют.
Похожие работы
... и псевдогалогенами. Конечная точка титрования может быть установлена различными способами, вошедшими в литературу под именами их авторов (см. табл.1.11.1). ТКТ в седиметрии рассчитывают не для выбора индикатора, а для выявления возможности седиметрического титрования и оптимизации его условий (концентрации растворов). Критерием является наличие и величина скачка титрования на графике ТКТ. При ...
... , основанной на поглощении атомами рентгеновского излучения. Ультрафиолетовая спектрофотометрия — наиболее простой и широко применяемый в фармации абсорбционный метод анализа. Его используют на всех этапах фармацевтического анализа лекарственных препаратов (испытания подлинности, чистоты, количественное определение). Разработано большое число способов качественного и количественного анализа ...
... ) = q(NaOH) и c учетом аликвотной части кислоты по методике (см. 2.2.1): mн(Н2С2О4 · 2H2O) N(NaOH) · V(NaOH) ----------------------------- = -------------------------- 10 Mэ(Н2С2О4 2H2O) 1000 Рассчитанную навеску взвешивают на аналитических демпферных весах. В мерную колбу со щавелевой кислотой порциями добавляют, обмывая воронку, 30-35 мл дистиллированной воды. Содержимое в колбе ...
... эквивалентности раствор обесцвечивается. Избыток [Hg2]2+-ионов реагирует с Fe(SCN)3 по уравнению: 3 [Hg2]2+ + 2 Fe(SCN)3 → 3Hg2(SCN)2 + 2Fe3+ 2.3 Инструментальные методы определения хлорид-ионов 2.3.1 Нефелометрическое определение хлоридов При прохождении пучка света через дисперсные системы наблюдается рассеяние или поглощение света твердыми частицами. Это явление положено в ...

0 комментариев