Навигация
Аналитическая химия
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ
УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
КИНО И ТЕЛЕВИДЕНИЯ»
Кафедра общей, органической и физической химии
АНАЛИТИЧЕСКАЯ ХИМИЯ
Методические указания к выполнению лабораторных работ
по количественному анализу
для студентов очного и очно-заочного отделений
Составители: доц. Е.В. Зиненко, проф. А.Ю. Ершов
Рецензент: к.т.н., доцент В.В. Митрофанов
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
1. ПРИЕМЫ РАБОТЫ В ТИТРИМЕТРИЧЕСКОМ АНАЛИЗЕ
1.1. Подготовка посуды
1.1.1. Соизмерение мерной колбы и пипетки
1.2. Приготовление раствора в мерной колбе и отбор аликвотной части
1.3. Приготовление титрованных растворов
1.4. Подготовка бюретки
1.5. Взятие навески.
1.6. Титрование
2. МЕТОДЫ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
2.1. Приготовление раствора хлороводородной кислоты
2.2. Стандартизация 0,1 М раствора НСl
2.2.1. Приготовление раствора тетрабората натрия
2.2.2. Определение точной концентрации раствора хлороводородной кислоты.
2.3. Приготовление раствора гидроксида натрия
2.4. Стандартизация 0,1 н раствора NаОН
2.4.1. Приготовление раствора щавелевой кислоты
2.4.2. Определение точной концентрации раствора гидроксида натрия
2.5. Стандартизация рабочих растворов потенциометрическим методом
Лабораторная работа №1 "Определение содержания КОН в растворе"
Лабораторная работа №2 "Определение содержания серной кислоты в растворе"
Лабораторная работа №3 "Определение содержания карбоната- и гидро-карбоната натрия при совместном присутствии"
Лабораторная работа №4 "Определение содержания соды в смеси с хлори-дом натрия"
Лабораторная работа №5 "Определение содержания щавелевой кислоты в смеси с хлоридом натрия"
3. МЕТОДЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОГО ТИТРОВАНИЯ.
3.1. ПЕРМАНГАНАТОМЕТРИЯ
3.2. Стандартизация раствора КМnО4
Лабораторная работа №6 "Определение содержания Fе(II) и Fе(III) при сов-местном присутствии с применением редуктора
3.3. ЙОДОМЕТРИЯ
3.4. Стандартизация раствора тиосульфата натрия
3.5. Стандартизация раствора йода
Лабораторная работа №7 "Определение гексацианоферрат (II) калия"
4. МЕТОДЫ ОСАДИТЕЛЬНОГО ТИТРОВАНИЯ
4.1.АРГЕНТОМЕТРИЯ
4.2. Стандартизация раствора нитрата серебра методом Мора
4.3. Стандартизация раствора роданида аммония
Лабораторная работа №9 "Определение бромида калия методом Фольгарда"
Лабораторная работа №10 "Потенциометрическое определение хлорид-, бро-мид- и йодидионов при совместном присутствии"
5. МЕТОДЫ КОМПЛЕКСОНОМЕТРИЧЕСКОГО ТИТРОВАНИЯ
5.1. Стандартизация раствора Трилон Б
Лабораторная работа №11 "Определение содержания Аl3+ методом обрат-ного титрования"
Лабораторная работа №12 "Определение общей жесткости воды"
6. ПОТЕНЦИОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
6.4. Правила работы на рН-метре-милливольтметре
6.5. Обработка результатов потенциометрического титрования
ЛИТЕРАТУРА
ВВЕДЕНИЕ
Практическое применение методов титриметрического анализа требует знания теоретических основ, поэтому к выполнению лабораторных работ можно приступать только после изучения соответствующих разделов курса, а также методических указаний. При выполнении лабораторных работ экспериментальные данные записывают в рабочем журнале, там же выполняют все необходимые расчеты.
Наиболее важной операцией в титриметрическом анализе является титрование − процесс непрерывного контролируемого смешивания стандартного раствора и раствора определяемого вещества.
Для титрования используют раствор химического реагента точно известной концентрации, называемый стандартным или титрованным. Стандартный раствор, применяемый для титрования, называют также титрантом или рабочим раствором.
При титровании к раствору определяемого вещества А постепенно приливают из мерного сосуда (бюретки) титрованный раствор реагента В:
аА + bВ → продукты реакции, где а и b стехиометрические коэффициенты реакции, причем а > b.
Когда количества мг-экв реагирующих веществ становятся стехиометричными (эквивалентными), т.е. q(А) = q(В), достигается точка эквивалентности и титрование заканчивают. Этот момент обычно определяют с помощью индикаторов по изменению их окраски в анализируемом растворе. В этот момент можно записать:
А + (b/а)В → продукты реакции.
Отношение b/а обозначают символом fэкв и называют фактором эквивалентности вещества, т.е. fэкв(В) = b/а. Фактор эквивалентности − величина безразмерная, равная или меньшая единицы. При работе с растворами необходимо использовать их количественную характеристику − концентрацию растворенного вещества. Известно несколько способов выражения концентрации раствора:
Молярность (с) − показывает, какое количество моль (ммоль) вещества растворено в 1 литре (1 мл) раствора.
Нормальность (N или н) − показывает, какое количество грамм-эквивалентов (мг-экв) вещества растворено в 1 литре (1 мл) раствора.
Титр (Т) − показывает число грамм или миллиграмм растворенного вещества в 1 миллилитре раствора.
Массовая доля (ω) − показывает число грамм вещества, растворенное в 100 граммах раствора.
Расчет результатов объемного анализа основан на принципе эквивалентности, и количество вещества (q) можно выразить через различные концентрации:
mн · 1000 Т· V · 1000 V · ρ · ω ·1000
q = N·V = --------------- = ---------------- = --------------------, где
Мэ Мэ Мэ · 100%
q – количество вещества, мг-экв;
N – нормальность раствора, мг-экв/мл;
V – объем раствора, мл;
mн – масса навески вещества, г;
1000 – коэффициент, переводящий граммы в миллиграммы;
Т – титр раствора, г/мл;
ρ – плотность раствора, г/мл3;
ω – массовая доля раствора, % или как часть от 1;
Мэ − масса эквивалента вещества (Мэ = М · fэкв , где М − молярная масса вещества).
1. ПРИЕМЫ РАБОТЫ В ТИТРИМЕТРИЧЕСКОМ АНАЛИЗЕ
1.1 Подготовка посуды
Чистота стеклянной посуды определяется по смачиваемости стенок водой: чистое стекло легко смачивается водой, и при выливании ее из сосуда на чистой поверхности остается сплошная тонкая пленка, тогда как на загрязненной поверхности стекла вода собирается в капли. Если отмыть сосуд водой не удается, применяют активные реагенты, например «хромовую смесь» (насыщенный раствор бихромата калия в концентрированной серной кислоте). После этого посуда промывается проточной водой и ополаскивается дистиллированной водой.
Похожие работы
... химия не только обеспечила эти области эффективными методами анализа, но и послужила основой разработки многих новых технологических процессов. Основные этапы развития аналитической химии Многие практические приемы аналитической химии и аналитические методики были известны в глубокой древности. Это, прежде всего пробирное искусство, или пробирный анализ, который выполнялся «сухим» путем, т. ...
... соответствует знак (+) на пересечении строки 8 и столбца Ж. Можно дать и более подробную характеристику межпредметных связей - на уровне подразделов и примеров, а также перечни методов и понятий, но в настоящей статье такие детали вряд ли целесообразны. В таблице цифрами обозначены следующие разделы курса АХ: 1 - метрологические основы химического анализа; 2 - теория и практика пробоотбора; 3 - ...
... АНАЛИЗА 4.1. Теории кислотно-основных индикаторов Кроме использования органических соединений для образования металлокомплексов, образования окрашенных соединений органические реагенты используются очень широко в аналитической химии в качестве индикаторов методов кислотно-основного титрования. Индикатор – это вещество, которое проявляет видимое изменение в точке эквивалентности или вблизи ...
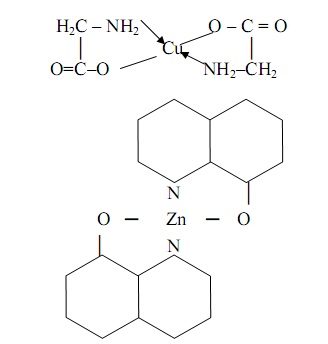
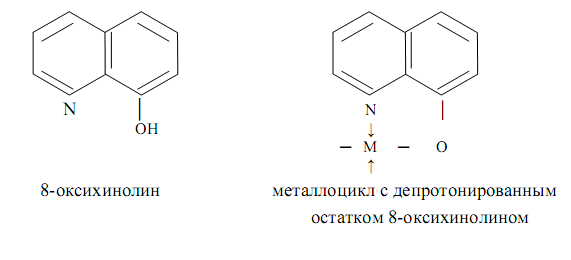
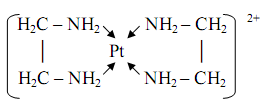
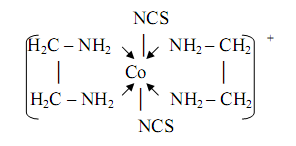
... ;à НbО2- + ННb + СО2 Кислотно-основные свойства лигандов, связанных с комплексообразователем, часто выражены более ярко, чем кислотно-основные свойства свободных лигандов. 4. Комплексные соединения в аналитической химии 4.1 Качественный анализ катионов Первая группа катионов В первую аналитическую группу катионов входят ионов калия K+, натрия Na+, аммония NH4+ и магния Mg2+. ...
0 комментариев