Навигация
Приведите примеры химических реакций, подтверждающих три случая протекания обмена до конца. Напишите их уравнения в молекулярном и ионном видах [23]
2. Приведите примеры химических реакций, подтверждающих три случая протекания обмена до конца. Напишите их уравнения в молекулярном и ионном видах [23].
При изучении темы «Растворы» планируется решение расчетных задач. Так, авторы статьи [24] предлагают рассмотреть расчетные задачи на растворы, требующие глубокого понимания этого вопроса. Практика показывает, что наиболее успешно учащиеся справляются с задачами по растворам в том случае, если им были предложены простые графологические схемы и легко запоминающиеся алгоритмы решения, приводящие к составлению алгебраических уравнений. Использование алгоритмов представляет собой формальный путь решения задачи, лишающий учащихся возможности в полной мере проявить свои творческие способности.
В основу решения авторы [24] предлагают положить закон сохранения массы вещества, в соответствии с которым сумма масс растворенного вещества в смешиваемых растворах равна массе растворенного вещества в новом растворе. Массу растворенного вещества рассчитываем следующим образом:
m=m(p – pa) × w , где w - массовая доля растворенного вещества в
растворе.
А, в случае смешивания двух растворов, массу растворенного вещества можно выразить с помощью уравнения:
m1 × w1 + m2 × w2 = (m1 + m2) × w , где m1 + m2 - масса нового раствора.
Графологическая схема, отражающая это соотношение, служит основой предлагаемого алгоритма решения:
w1 w2 w
|
|
|
Рассмотрим примеры:
Задача 1.
Какую массу 5% -ного раствора щелочи надо добавить к 200 г 40% -ного раствора, чтобы получить 25% -ный раствор?
1. Запишем кратко условие задачи.
Дано:
w1% = 5%; w1 = 0,05
w2 % = 40%; w2 = 0,4
w% = 25%; w = 0,25
m2 = 200 г
m1 - ?
2. Составим схему смешивания растворов:
0,05 0,4 0,25
|
|
|
3. Умножим массу каждого раствора, изображаемого на схеме, на соответствующую массовую долю, составим уравнение и решим его.
Х × 0,05 + 200 × 0,4 = (Х + 200) × 0,25
0,05 Х + 80 = 0,25 Х + 50
0,2 Х = 30
Х = 150
Ответ: Надо добавить 150 г 5% -ного раствора щелочи.
Задача 2.
Из 400 г 20% раствора при охлаждении выделилось 50 г растворенного вещества. Чему равна массовая доля этого вещества в оставшемся растворе?
Учащимся объясняют, что в задачах такого типа чистое безводное вещество условно считать раствором с массовой долей 1 (w% = 100%), для воды соответственно имеет w=0, после этого учащиеся решают задачу с помощью алгоритма.
1. Дано:
w1% = 20%; w1 = 0,2
w2 % = 100%; w2 = 1
m1 = 400 г
m2 = 50 г
w - ?
2.
0,2 1 Х
|
|
|
3. 400 × 0,2 – 50 × 1 = 350 Х
Х = 0,086
Ответ: Массовая доля вещества в оставшемся растворе составляет 0,086
или 8,6%
Задача 3.
В какой массе воды нужно растворить 125 г медного купороса, чтобы получить 8% - ный раствор сульфата меди?
1. Дано:
М(CuSO4 × 5H2O) = 250 г/моль
m = 125 г
w% = 8%; w = 0,08
М(CuSO4) = 160 г/моль
m(H2O) - ?
2. Рассчитаем массовую долю CuSO4 в медном купоросе.
160 г/моль
w1 = ¾¾¾¾¾¾¾
250 г/моль
3.
0,64 0 0,08
|
|
|
4. 125 × 0,64 = (125 + Х) × 0,08
Х = 875
Ответ: Потребуется 875 г воды.
Одним из вопросов изучаемых теорией растворов являются коллоидные системы. Небольшой раздел этой темы включается в курс химии 11-го класса [25]. Дается классификация дисперсных систем, раскрывается их значение в практике, приводится характеристика дисперсных систем по внешнему виду, способности осаждаться, задерживаться фильтрами. Авторы приводят достаточно детальную характеристику коллоидных растворов, вводится понятие коагуляции, десорбция заряженных ионов. Приводятся примеры коллоидных растворов и их роль в повседневной жизни.
Более подробно коллоидные растворы характеризуются авторами [26] . Отличительной особенностью коллоидов является их многофазность, которую легко обнаружить с помощью ультрамикроскопа или при пропускании из них пучков света через раствор. Многократное отражение падающего света от частиц коллоидных размеров делает их «видимыми» невооруженным глазом (эффект Тиндаля). Итак, коллоиды – механическая смесь нескольких фаз, но очень необычная, отличающаяся от типичных механических смесей огромной поверхностью раздела фаз.
Создание монодисперсного коллоида – дело не простое, но крайне важное когда речь идет о материалах со структурно-чувствительными свойствами. Например, в высокоинтенсивных источниках света сейчас используют вольфрамовые катоды, которые являются композицией вольфрама и оксида тория (IV). В них очень мелкие частички вольфрама разделены тончайшими оксидными прослойками. Композиция работает как катод тем лучше, чем однороднее распределение компонентов [25].
Самый распространенный и наиболее изученный тип коллоидных растворов составляют системы твердое в жидком. К ним относятся истинные коллоиды – суспензии (зубная паста, лекарства, концентрированная суспензия алюмосиликатов, используемая в производстве фарфора).
Авторами [25] рассматривается свойство коллоидов. Отмечено, что коллоиды, это неопределенные вещества, а вполне определенное состояние, в котором может находиться большинство веществ.
Одной из важнейших коллоидных систем являются аэрозоли – системы, в которых жидкие или твердые частицы дисперсной фазы свободно перемещаются в газообразной дисперсионной среде. Для разрушения аэрозолей в промышленности используются электрофильтры. Между электродом и стенкой создается высокое напряжение – в несколько тысяч вольт. При электрическом разряде газа возникает большое число ионов, которые абсорбируются на частицах аэрозоля. Последние движутся под влиянием электрического поля к электродам, где коагулируют, а затем осаждаются на дне фильтра.
Наука о коллоидах, созданная в последние десятилетия, позволяет решать многие научно-технические и экологические проблемы, начиная от создания материалов с небольшим сочетанием свойств и кончая предотвращением взрывов в каменноугольных шахтах. Таким образом, растворы многообразны и играют большую роль в жизни и деятельности человека. Правильное отношение к веществам, растворам, их использованию и экологии необходимо воспитывать со школьной скамьи.
Глава 3. Реакции взаимодействия металлов с растворами солей.
Эксперимент по коллоидным растворам.
Большую роль в формировании знаний учащихся о веществе играет так же понятие о растворах.
В современном школьном курсе химии изучение растворов на начальном этапе обучения производится с целью ознакомления учащихся со средой, в которой протекают многочисленные химические реакции. Затем с растворами школьники встречаются при изучении вопросов электролитической диссоциации (растворы – электролиты), элементов главной подгруппы IV группы (коллоидные растворы). Обобщение знаний о растворах проводят в курсе химии 11-го класса.
Если говорить о классификации растворов, то можно выделить:
1. По гемогенности – это однородные системы.
2. По числу компонентов. Двухкомпонентные системы состоят из растворителя и растворенного вещества.
3. По агрегатному состоянию различают: газообразные, жидкие и твердые растворы.
Теория растворов достаточно хорошо изложена в научной и методической литературе. В первой главе мы коснулись вопроса создания проблемных ситуаций при изучении реакций в растворах на примере реакций металлов с солями и гидролиза. Тема «Гидролиз» раскрыта полностью. Реакциям металлов с солями и эксперименту по коллоидным системам повещена данная глава.
Часть 1. Реакция металлов с растворами солей.
Школьникам была поставлена задача:
В раствор сульфата меди внесите небольшой кусочек металлического лития и объясните причину образования осадка черного цвета.
Решение можно выразить следующей схемой:
Схема 1.
Решение проблемного эксперимента.
|
|
В общем изучаемый процесс вместе со школьниками изображаем условно:
CuSO4 + Li ® CuO¯ + H2
исходные вещества наблюдаемые экспериментально продукты
Вспоминаем, какие химические свойства металлов характеризует ряд стандартных электродных потенциалов:
1. Чем более отрицателен электродный потенциал металла, тем больше его восстановительная способность.
2. Каждый металл, имеющий более отрицательный потенциал, способен вытеснять (восстанавливать) из раствора солей те металлы, которые имеют более положительный потенциал.
Вспоминаем, что исключение составляют лишь щелочные и щелочноземельные металлы, которые не восстанавливают ионы других металлов из растворов их солей, что связано с тем, что скорость их взаимодействия с водой, т.е. гидратация значительно превышает скорость вытеснения иона металла.
3. Все металлы, имеющие отрицательный стандартный электродный потенциал, т.е. находящиеся в ряду напряжения металлов левее водорода, способны вытеснять его из растворов кислот. К этому добавляем, что самые активные металлы вытесняют водород и из воды.
Таким образом, в систему введены - сульфат меди, вода и литий. Исследуем какие возможны процессы:
- литий реагирует с водой, при этом выделяется водород, что согласуется с наблюдаемыми признаками реакции:
2Li + 2H2O ® 2LiOH + H2
Образовавшийся гидроксид лития, должен реагировать с сульфатом меди с образованием осадка гидроксида меди голубого цвета:
CuSO4 + 2LiOH ® Cu(OH)2¯ + Li2SO4
Образование осадка черного, а не голубого, цвета вызвало удивление у школьников. Проделываем опыт по взаимодействию лития не с солью, а с водой и измеряем выделившуюся при этом температуру (70°С):
2Li + 2H2O ® 2LiOH + H2 + Q
Выдвигаем гипотезу, что выделившейся при реакции гидратации лития теплоты, достаточно для разложения образовавшегося гидроксида меди:
t°
Cu(OH)2 ® CuO + H2O ( t° разложения 50°С)
осадок осадок
голубого черного
цвета цвета
Часть 2. Эксперимент по коллоидным системам.
Прежде всего, на наш взгляд, крайне интересным является вопрос о начале коллоидной науки.
Поздним осенним вечером [27] в лаборатории Британского монетного двора работали два человека. Один из них заведующий лабораторией Томас Грэм, а другой – директор монетного двора Вильям Робертс.
Меня интересует один серьезный вопрос – заговорил Грэм, это непонятные свойства кремниевой кислоты – иногда она не выпадает в осадок и остается в растворе. Я хочу заняться их изучением.
Грэм подошел к большому шкафу, достал несколько склянок и поднес их к свече. Растворы были прозрачными. Он наклонил одну из склянок, чтобы удостовериться, что на дне нет осадка. Однако раствор был неподвижен, он превратился в прозрачную желеобразную массу.
- И это раствор кремниевой кислоты? – произнес удивленный Робертс.
- Да! Посмотрите, какое желе получилось! Как будто я сварил крахмал и оставил его остывать. Постойте-постойте! Крахмал… по гречески крахмал называется «колла», т.е. клей. Не следует ли назвать этот раствор коллоидным? Это будет указывать на то, что они похожи на раствор крахмала.
Именно в тот вечер Грэм пришел к убеждению, что существуют два вида растворов – истинные и коллоидные. Грэм исследовал свойства коллоидных растворов, показал, что они неустойчивы и растворенное вещество может легко выделяться в виде осадка. Этот процесс был назван коагуляцией.
Исследования Грэма показали, что коагуляция вызывается не только добавлением в раствор солей, кислот или оснований, но и повышением температуры, продолжительным перемешиванием или иногда просто длительным отстаиванием.
Итак, появилось понятие коллоидные растворы.
Не менее интересна другая история.
На одном из заседаний Лондонского химического общества в 1867 г. к Грэму подошел Джон Тиндаль и заговорил о волновавшем его вопросе [27]:
- Я с некоторых пор изучаю рассеяние света при прохождении через мутные растворы. Коллоидные растворы тоже меня заинтересовали, и я буду просить у вас каких-либо практических указаний о получении чистых коллоидных растворов.
Скоро Тиндаль имел в своем распоряжении очищенные путем диализа коллоидные растворы и начал свои опыты.
Тиндаль наполнил стеклянную ванну коричневым раствором золя гидроокиси железа. Раствор был совершенно прозрачным и не отличался по цвету от раствора дихромата калия, например. Плотным экраном Тиндаль прикрыл лампу. Только тонкий пучок лучей пробивался через небольшое отверстие в центре экрана. Профессор направил эти лучи на ванну с коллоидным раствором. Вместо ожидаемого четко ограниченного пятна на экране появился размытый, неясноочерченный светлый круг. Тиндаль был поражен. Прошло несколько минут, а он все не мог оторваться от этой красоты, как будто в ванну было погружено какое-то тело, излучающее свет. Лучи входили в раствор, образуя круг небольшого диаметра, который постепенно увеличивался к противоположной стене ванны, образуя светящийся конус.
Эта история об открытии известного в науке эффекта Тиндаля. Результаты опытов подтвердили его первоначальные наблюдения. Попадая в коллоидный раствор пучок лучей рассеивался, образуя светящийся конус.
В 1899 г. английский физик Джон Вильям Рэлэй нашел объяснение двойному цвету коллоидных растворов и вывел формулу, которая представляла собой закон рассеивания света.
Белый свет состоит из лучей разной длинны волн: от синих – с наименьшей длинной волн, до красных – с наибольшей длинной. Когда сложный световой луч встречается с маленькой коллоидной частицей, красные лучи не изменяются, а продолжают свой путь, потому, что длинна их волн на много больше размеров частицы. А для синих лучей эта же частица является непреодолимым препятствием, потому, что ее размеры больше длинны волн синих лучей. Поэтому синие лучи отражаются от коллоидных частиц. Это приводит к обогащению проходящего через раствор света красными лучами и к отражению синих лучей.
В курсе химии средней школы с коллоидными растворами школьники встречаются в 11-ом классе при обобщении знаний по теме «Растворы», но на более высоком уровне [25].
Авторы отмечают, что коллоидные растворы имеют размер от 1 до 100 нм и относятся к тонкодисперсным системам (например, раствор яичного белка в воде). Они прозрачны, отдельные частицы обнаруживаются только при помощи ультрамикроскопа, осаждаются с трудом. Задерживаются только ультрафильтрами с очень маленькими порами (пергаментная бумага, животный пузырь). Коллоидные растворы имеют большое значение. Они образуются при растворении в воде некоторых высокомолекулярных веществ (белков), а также при химических реакциях, например, при взаимодействии растворов силикатов с кислотами выделяется кремниевая кислота, образующая с водой коллоидный раствор. По прозрачности коллоидные растворы схожи с истинными растворами. Но при пропускании луча света через них наблюдается отличие: в коллоидном растворе появляются светящийся конус, так как коллоидные частицы крупнее частиц в истинных растворах и поэтому способны рассеивать проходящий свет.
Таким образом, теоретические данные совпали с экспериментальными, что делает гипотезу достоверной.
Проверку проводили следующим образом: по реакции обмена готовили гидроксид меди (II) и вносили литий:
CuSO4 + 2LiOH ® Cu(OH)2¯ + Li2SO4
и вновь подтверждали, что теплоты реакции взаимодействия лития с водой достаточно для разложения гидроксида меди (II) на оксид и воду.
Опыты по взаимодействию лития с солями железа (III), никеля, алюминия, магния показали, что в данном случае образуются только гидроксиды, т.к. выделяемой при взаимодействии лития с водой теплоты в данном случае недостаточно для разложения гидроксидов Fe(OH)3, Ni(OH)2, Mg(OH)2 .
Использование проблемного эксперимента способствует развитию мышления школьников, повышает их творческий потенциал и активность, а также отвечает принципам развивающего обучения.
Проблемный эксперимент позволяет преодолеть односторонность, формирует более точный, многогранный взгляд на изучаемое явление, способствует установлению взаимосвязи между ними с позиции теории и окислительно-восстановительных процессов. Обучение может быть усиленным тогда, когда деятельность учителя сопровождается активной и творческой деятельностью учащихся. Условие для развития творческих способностей учащихся создается только тогда, когда проблемные ситуации образуют определенную систему.
Учащиеся, получив неожиданные экспериментальные данные, включают их в систему своих представлений по данному вопросу, объясняют опыты, устанавливают новые связи с уже известными фактами и, обогащаясь новыми экспериментальными и теоретическими сведениями приходят к пониманию более глубоких и сложных закономерностей.
Следующий опыт касался взаимодействия кальция с растворами хлорида меди (II), хлорида железа (III).
В штатив поместили пробирки с растворами хлорида меди (II) и хлорида железа (III) и вносим в каждую тщательно зачищенные кусочки кальция. В первом случае наблюдаем бурное протекание реакции с образованием газа и нерастворимых веществ различной окраски. Если поджечь газ, он горит, следовательно это водород. Внешний вид нерастворимых веществ указывает, что образуется смесь различных осадков: в начале синего цвета, с течением времени окраска меняется на беловато-голубой.
Во втором случае также наблюдается выделение водорода и образование осадков: бурого и светло-желтого цвета. Данный опыт противоречит результатам полученных по взаимодействию лития с сульфатом меди. Требуется поиск для объяснения результатов эксперимента. Выдвигается гипотеза: очевидно, кальций реагируя с водой, находящейся в растворе солей, образует основание, вступающее в обменную реакцию с растворами солей и в осадок выпадают соответствующие гидроксиды:
- по первому опыту:
Ca + 2H2O ® Ca(OH)2 + H2
Ca(OH)2 + CuCl2 ® Cu(OH)2¯ + CaCl2
или:
Ca + 2H2O + CuCl2 ® Cu(OH)2¯ + H2 + CaCl2
- по второму опыту:
Ca + 2H2O ® Ca(OH)2 + H2
3Ca(OH)2 + 2FeCl3 ® 2Fe(OH)3¯ + 3CaCl2
или:
3Ca + 6H2O + 2FeCl3 ® 2Fe(OH)3¯ + 3H2 + 3CaCl2
После составления суммарных уравнений реакций обращаем внимание на то, что продуктами взаимодействия являются и малорастворимый гидроксид кальция и различные основные соли.
На вопрос почему в данном случае не образуется осадок черного цвета оксида меди (II), последовал логичный ответ, что при гидратации кальция теплоты выделяется меньше, чем при гидратации лития, а ее недостаточно для разложения Cu(OH)2 .
Данный демонстрационный эксперимент с использованием проблемного подхода, по реакции лития и кальция с солями, является убедительным и доказательным: действительно щелочные и щелочноземельные металлы не вытесняют менее активные металлы из растворов солей, а протекают более сложные процессы, в которых участвуют как молекулы воды, так и частицы соли.
Для проведения диализа коллоидных систем был избран оригинальный диализатор – природный образец (куриная скорлупа).
Для проведения эксперимента были использованы следующие системы:
Система 1: раствор белка – сульфат аммония,
Система 2: раствор белка – сульфат натрия,
Система 3: раствор белка – хлорид натрия.
Наполовину разбавленный раствор белка вносили в яичную скорлупу, приливали насыщенный раствор соли и помещали подготовленные системы (1, 2, 3) в стакан с дистиллированной водой. Через определенные промежутки времени ( 1 час, 2часа и т.д.) брали пробу из стаканов и приливали растворы BaCl2
к системам (1, 2) и AgNO3 к системе (3). Выпадали осадки сульфата бария и хлорида серебра. Эксперимент показал, что естественный продукт яичная скорлупа может быть использована для проведения диализа коллоидных систем.
Для наблюдения эффекта Тиндаля нами был сконструирован прибор, использованный в период педагогической практики в школе №7 г. Тамбова, на уроках химии в 11-ом классе (рис.2).
Использованные системы:
1. Раствор силиката натрия.
2. Раствор яичного белка.
3. Раствор 3% желатина.
4. Раствор хлорид железа (III).
Рис. 2 Прибор для демонстрации эффекта Тиндаля в коллоидных растворах.
Выводы.
1. Проведена литературная проработка по теме дипломной работы.
2. Разработана методика формирования химического языка в курсе химии средней школы.
3. Приведены примеры и методика решения задач по химическим формулам.
4. Использован проблемный метод обучения при изучении взаимодействия активных металлов с водой.
5. Разработан конспект проблемного урока по теме «Годролиз», опробированный в 9-ом классе школы №7 г. Тамбова.
6. Подобраны системы для проведения диализа с использованием естественного продукта – яичной скорлупы.
7. Изготовлен и применен на практике прибор для демонстрации эффекта Тиндаля.
Использованная литература.
1. Г.Е. Рудзитис, Ф.Г. Фельдман. Химия 8-й класс. М.: Просвещение. 1999.
с.5 -47.
2. Л.С. Гузей, В.В. Сорокин, Р.П. Суровцева. Химия 8-й класс. М. Изд. дом «Дрофа». 1999. с. 5 – 46.
3. Н.С. Ахметов. Химия. Учебник для 8-го класса общеобразовательных учреждений. М.: Просвещение. 1998. с. 5 – 46.
4. Методика преподавания химии под редакцией Н.Е. Кузнецовой. М.: Просвещение. 1984. с. 79.
5. Д.И. Менделеев. Основы химии. т. 1. Изд. одиннадцатое. М. – Л., Гостехиздат. 1932. с. 480.
6. И.Н. Семенов. Задачи по химии повышенной сложности для абитуриентов. ч. 2. Изд. Ленинградского университета. 1991. с. 3.
7. И.Н. Семенов. Задачи по химии повышенной сложности для абитуриентов. ч. 1. Изд. Ленинградского университета. 1991. с. 4.
8. Задачи по химии. Выпуск 7. Воронежская медицинская академия им. Н.Н. Бурденко. Воронеж. 1997. с. 2.
9. Сборник упражнений и задач по органической химии. Саратовский государственный медицинский университет. Саратов. 1999. с. 4.
10. Методические указания и контрольные задания по химии. Г.И. Гущина со- ставитель. Пермская государственная фармацевтическая академия. Пермь. 2000. с. 12.
11. Ф.А. Чмиленко, И.Г. Виниченко, Г.С. Чмиленко. Подготовка к эксперименту по химии с контролем на ЭВМ. «Школа – пресс». М. 1994. с. 20.
12. В.Н. Верховский, А.Д. Смирнов. Техника химического эксперимента. т.1. М.: Просвещение. 19973. с. 360.
13. К.Я. Парменов. Химический эксперимент в средней школе. М., Из-во АПН РСФСР, 1959. с. 30-50.
14. В.С. Полосин, В.Г. Прокопенко. Практикум по методике преподавания химии. М., Просвещение. 1989. с. 300.
15. В.С. Полосин. Школьный химический эксперимент по неорганической химии. М., Просвещение. 1989. с. 200-207.
16. Г.М. Чернобельская. Основы методики обучения химии. М.: Просвещение. 1987. с. 57.
17. Р.И. Малафеев. Проблемное обучение физике в средней школе. М.: Просвешение. 1980.
18. Э.Г. Золотников. «Изучение растворимости веществ в воде». Ж. Химия в школе. №6. 94. с. 72-73.
19. В.Н. Головнер. «Семь превращений в одной пробирке». Ж. Химия в школе. №3. 2000. с. 61-64.
20. Т.Х. Чен, Е.Ю. Раткевич. «Методика определения общей жесткости воды». Ж. Химия в школе. №5. 2000. с. 80-81.
21. Е.В. Турлакова, Р.В. Дудла. «Урок по изучению химических свойств воды». Ж. Химия в школе. №1. 2000. с. 34-35.
22. Т.Н. Романина, Г.А. Шипарева. «Домашние эксперименты: интересно и познавательно». Ж. Химия в школе. №5. 98. с. 38-40.
23. Т.К. Толкачева. «Уровневая дифференциация – потребность времени». Ж. Химия в школе. №8. 2000. с. 15-18.
24. И.И. Геращенко. «Решение задач на растворы». Ж. Химия в школе. №5. 94. с. 47.
25. Г.Е. Рудзитис, Ф.Г. Фельдман. Химия. 11 класс. М.: Просвещение. 1999. с. 83-84.
26. Ю.Д. Третьяков, Ю.Г. Метлин. «Основы общей химии». Москва. Просвещение. 1980. с. 92-98.
27. К. Мачалов, Д. Лазаров, И. Лилов. У химии свои законы. Из-во «Химия». 1977. с. 86.
Похожие работы
... , как в общенаучном плане, так и прикладном плане. Это дает нам возможность проанализировать содержание данной темы в курсе химии средней школы. Глава 2. МЕТОДИКА ИЗУЧЕНИЯ КРИСТАЛЛОГИДРАТОВ В КУРСЕ ХИМИИ СРЕДНЕЙ ШКОЛЫ 2.1 Тема «Кристаллогидраты» в стандарте школьного образования Стандарт среднего (полного) общего образования по химии определяет собой обязательных минимум, который должен ...
... учебного процесса; 4) Абсолютно неудовлетворительная объективность оценки знаний обучающихся, невозможность сопоставления оценок, полученных или разных обучающих или, тем более, в разных учебных заведениях [10]. 1.8 Тестовый контроль знаний на уроках химии В последние годы в связи с проведением в стране эксперимента по внедрению единого государственного экзамена (ЕГЭ) тестовые задания все ...
... современного состояния науки и содержания предметной области “Химия” и “Биология” в средней общеобразовательной школе. Она соответствует требованиям Государственного образовательного стандарта школьного курса по химии, биологии и представляет собой модульную обучающую систему, в которой ученик самостоятельно приобретает знания, а учитель осуществляет мотивированное управление его обучением ( ...
... раствор содержит 39,2 г фосфорной кислоты. Его нейтрализовали раствором, содержащим 37 г гидроксида кальция. Найдите массу полученного преципитата. Глава 2. Изучение минеральных удобрений в школе В школьном курсе химии минеральные удобрения рассматриваются подробно в IX классе. Как известно, состав удобрений, их свойства, применение и эффективность изучает специальная наука — агрохимия ( ...

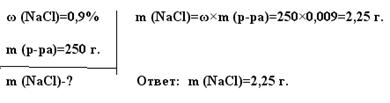





0 комментариев