Навигация
Министерство Образования Республики Беларусь
Белорусский Национальный Технический Университет
Кафедра Химии
Реферат на тему:
Химия меди
Исполнитель: Кузьмич А.Н. гр. 104312
______________________
Руководитель: Медведев Д.И.
______________________
Минск - 2003
Содержание.
| стр. | ||
| Введение | 2 | |
| 1. | Историческая справка | 4 |
| 2. | Положение меди в периодической системе Д.И. Менделеева | 5 |
| 3. | Распространение в природе | 6 |
| 4. | Получение | 8 |
| 5. | Физические свойства | 10 |
| 6. | Химические свойства | 11 |
| 7. | Применение | 16 |
| 8. | Сплавы меди | 18 |
| 8.1 | Латуни | 18 |
| 8.2 | Оловянные бронзы | 19 |
| 8.3 | Алюминиевые бронзы | 19 |
| 8.4 | Кремнистые бронзы | 20 |
| 8.5 | Бериллиевые бронзы | 21 |
| 8.6 | Сплавы меди с никелем | 21 |
| Заключение | 22 | |
| Литература | 24 |
Введение.
Медь (лат. Cuprum) - химический элемент. Один из семи металлов, известных с глубокой древности. По некоторым археологическим данным - медь была хорошо известна египтянам еще за 4000 лет до н. э. Знакомство человечества с медью относится к более ранней эпохе, чем с железом; это объясняется с одной стороны более частым нахождением меди в свободном состоянии на поверхности земли, а с другой сравнительной легкостью получения ее из соединений. Особенно важна медь для электротехники. По электропроводности медь занимает второе место среди всех металлов, после серебра. Однако в наши дни во всем мире электрические провода, на которые раньше уходила почти половина выплавляемой меди, все чаще делают из алюминия. Он хуже проводит ток, но легче и доступнее. Медь же, как и многие другие цветные металлы, становится все дефицитнее. Если в 19 в. медь добывалась из руд, где содержалось 6-9% этого элемента, то сейчас 5%-ные медные руды считаются очень богатыми, а промышленность многих стран перерабатывает руды, в которых всего 0,5% меди.
Медь - необходимый для растений и животных микроэлемент. Основная биохимическая функция меди – это участие в ферментативных реакциях в качестве активатора или в составе медьсодержащих ферментов. Количество меди в растениях колеблется от 0,0001 до 0,05 % (на сухое вещество) и зависит от вида растения и содержания меди в почве. В растениях медь входит в состав ферментов-оксидаз и белка пластоцианина. В оптимальных концентрациях медь повышает холодостойкость растений, способствует их росту и развитию. Среди животных наиболее богаты медью некоторые беспозвоночные (у моллюсков и ракообразных в гемоцианине содержится 0,15-0,26 % меди). Поступая с пищей, медь всасывается в кишечнике, связывается с белком сыворотки крови - альбумином, затем поглощается печенью, откуда в составе белка церулоплазмина возвращается в кровь и доставляется к органам и тканям.
Содержание меди у человека колеблется (на 100 г сухой массы) от 5 мг в печени до 0,7 мг в костях, в жидкостях тела - от 100 мкг (на 100 мл) в крови до 10 мкг в спинномозговой жидкости; всего меди в организме взрослого человека около 100 мг. Медь входит в состав ряда ферментов (например, тирозиназы, цитохромоксидазы), стимулирует кроветворную функцию костного мозга. Малые дозы меди влияют на обмен углеводов (снижение содержания сахара в крови), минеральных веществ (уменьшение в крови количества фосфора) и др. Увеличение содержания меди в крови приводит к превращению минеральных соединений железа в органические, стимулирует использование накопленного в печени железа при синтезе гемоглобина.
При недостатке меди злаковые растения поражаются так называемой болезнью обработки, плодовые - экзантемой; у животных уменьшаются всасывание и использование железа, что приводит к анемии, сопровождающейся поносом и истощением. Применяются медные микроудобрения и подкормка животных солями меди. Отравление медью приводит к анемии, заболеванию печени, болезни Вильсона. У человека отравление возникает редко благодаря тонким механизмам всасывания и выведения меди. Однако в больших дозах медь вызывает рвоту; при всасывании меди может наступить общее отравление (понос, ослабление дыхания и сердечной деятельности, удушье, коматозное состояние).
Похожие работы
... к отрицательному полюсу, а закись меди к положительному, то движение электронов и положительных зарядов изменяется на обратное, и через систему проходит электрический ток. Так работает купроксный выпрямитель. [6, с.63] Гидроксиды меди. Гидроксид меди малорастворимое и нестойкое соединение. Получают его при действии щелочи на раствор соли: . Это ионная реакция и протекает она потому, что ...
... Ж + d —> g. В интервале концентраций 0,10—0,16% С оно приводит к полному затвердеванию, а в интервале 0,16—0,50% С кристаллизация завершается при охлаждении до температуры линии IE. В железоуглеродистых сплавах с 0,5—4,26% С кристаллизация начинается с выделения g-раствора также в виде дендритов. Стали полностью затвердевают в интервале температур, ограниченном линиями ВС и IE, приобретая ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
... ходом процесса. Через 3 минуты внесите в одну из пробирок раствор хлорида натрия. Что вы наблюдаете? Проведите анализ опытов а) и б). Глава 2. Методика изучения растворов. Теория растворов – одна из ведущих теорий курса химии. Причины важности темы кроется не только в том, что она имеет большое практическое значение, но и прежде всего ...




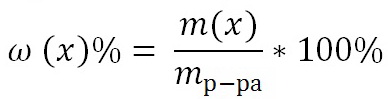
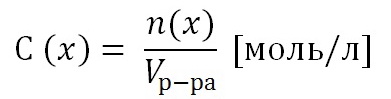
0 комментариев