Навигация
Зависимость подвижности ионов от температуры
2.1. Зависимость подвижности ионов от температуры
Предельные подвижности ионов, а также удельная электропроводность электролитов всегда увеличиваются с повышением температуры (в противоположность электропроводности металлов, которая ' уменьшается с повышением температуры). Температурный коэффициент подвижности l/u291(∆U/∆T ) оказывается довольно большим (~0,02); при нагревании раствора на 1 °С подвижность, а следовательно, и электропроводность возрастают примерно на 2%, что приводит к необходимости применять термостаты для точного измерения электропроводности. Наибольший температурный коэффициент характерен для ионов с относительно малой подвижностью и наоборот. Наличие положительного температурного коэффициента подвижности ионов, по-видимому, объясняется уменьшением вязкости с температурой.
Если это так, то, исходя из формулы Стокса (34), можно прийти к выводу, что
= const (35)
т. е. произведение подвижности (а следовательно, и электропроводности), на коэффициент вязкости является величиной постоянной и, следовательно, температурный коэффициент подвижности должен быть равен величине, обратной температурному коэффициенту вязкости. Действительно, температурный коэффициент подвижности большинства ионов в водных растворах равен 2,3—2,5%, в то время как величина, обратная температурному коэффициенту вязкости воды, равна 2,43%. Однако следует ожидать применимости закона Стокса и, следовательно, уравнения (XVIII, 18) лишь к ионам достаточно большого объема (см. стр. 403).
Произведение предельной подвижности иона (U0 , V0) на вязкость η0 растворителя почти не изменяется в широком диапазоне температур. Например, для ацетат-иона в водном растворе произведение V0η0 практически постоянно:
t°С- .......... О 18 25 59 75 100 128 153
V0η0.......... 0,366 0,368 0,366 0,368 0,369 0.368 0,369 0,369
В неводных растворах произведение V0η0 (или U0η0) также почти не изменяется с изменением температуры, но эта закономерность иногда и не совсем соблюдается.
Так как λ∞ = U0 + V0 то эквивалентная электропроводность при бесконечном разведении с температурой всегда возрастает.
При конечной концентрации связь эквивалентной электропроводности с подвижностью несколько сложнее. Для слабого электролита λ =(U + V) α. Если с повышением температуры подвижности ионов возрастают, то степень диссоциации может и уменьшаться, поскольку диэлектрическая проницаемость раствора при нагревании уменьшается, т. е. силы взаимодействия между ионами увеличиваются. Следовательно, кривая зависимости электропроводности от температуры может иметь максимум.
Аналогичное явление наблюдается и в сильных электролитах, так как при нагревании не только увеличивается подвижность ионов вследствие уменьшения вязкости, но уменьшения диэлектрическая проницаемость, что приводит к увеличению плотности ионной атмосферы, а следовательно, к увеличению электрофоретического и релаксационного торможений.
2.2. Зависимость подвижности ионов от кристаллохимических радиусов
Рассмотрим ряд ионов: Li+, Na+, K+. Как следует из уравнения движения, скорость движения ионов обратно пропорциональна их радиусу. В указанном ряду истинные радиусы ионов увеличиваются, и подвижности должны уменьшаться в той же последовательности.
В действительности в растворах подвижности ионов увеличиваются. Из этого можно сделать заключение, что в растворе и в ионной решетке ионы обладают различными радиусами. Чем меньше кристаллохимический радиус иона, тем больше его эффективный радиус в электролите. Это явление можно объясни тем, что в растворе ионы не свободны, а гидратированы или в общем случае сольватированы. Эффективный радиус движущегося электрическом поле иона будет определяться гидратации, количеством связанных с ионом молекул воды.
Многовалентные ионы в силу большой гидратной оболочки обладают минимальной подвижностью, так как гидратированы в наибольшей степени.
Ионы гадроксила и гидроксония обладают аномальной подвижностью - подвижность в растворах максимальна.
Предложено несколько теорий, объясняющих подвижность гидроксония и гидроксила. Одна .из теорий подвижность
H3O+ , ОН- объясняет с помощью эстафетного механизма. По теории эстафетного механизма происходит перескок протона с одной молекулы на другую, сопротивление электролита минимально, следовательно, подвижность увеличивается:
H3O+ + H2O = H2O + H3O+
Похожие работы
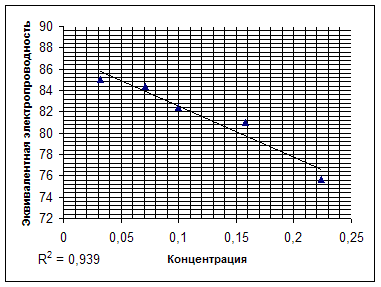
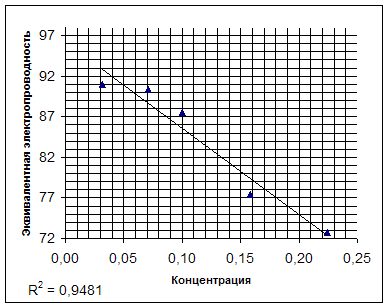
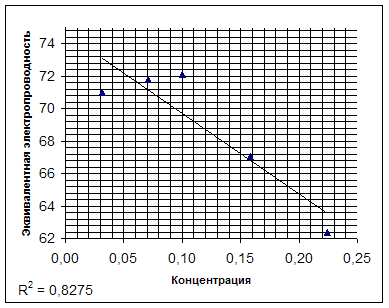
... к проводникам второго рода, для которых характерна ионная проводимость. Цель данной работы заключается в определении эквивалентной электропроводности лизина и установлении зависимости эквивалентной электропроводности от концентрации. Обзор литературы Мерой способности веществ проводить электрический ток является ...
... или кислот; так получают, например, золь гидроксида железа(III), имеющий следующее строение: {[Fe(OH)3]m n FeO+ · (n–x)Cl–}x+ x Cl– 4.2.2 Агрегативная устойчивость лиофобных коллоидов. Строение коллоидной мицеллы Лиофобные коллоиды обладают очень высокой поверхностной энергией и являются поэтому термодинамически неустойчивыми; это делает возможным самопроизвольный процесс уменьшения ...
... Планка; NA – число Авогадро; - приведенная масса молекулы электролита, г; сi – молярная концентрация ионов (сi= c0); с0 – исходная молярная концентрация электролита. 3. Изоморфизм уравнений При рассмотрении движения в поле вязких сил удобно ввести понятие подвижности b. Подвижность определяется как предельная скорость, приобретаемая телом под действием силы, равной единице, т. ...
... при изучении синтеза новых материалов и процессов ионного транспорта в них. В чистом виде такие закономерности наиболее четко прослеживаются при исследовании монокристаллических твердых электролитов. В то же время при использовании твердых электролитов в качестве рабочих сред функциональных элементов необходимо учитывать, что нужны материалы заданного вида и формы, например в виде плотной керамики ...
0 комментариев