Навигация
Закон разбавления Оствальда
5. Закон разбавления Оствальда.
При диссоциации слабого электролита устанавливается равновесие между недиссоциированными молекулами и ионами. Рассмотрим простейший пример, когда молекула распадается только на два иона:
СН3СООН + Н2О = СН3СОО- + Н3O+ (52)
На основании закона действия масс имеем
(53)
Как всякая константа равновесия, Кa зависит от температуры. Активность растворителя (в данном случае — воды) в разбавленных растворах можно считать постоянной. Это позволяет перенести aH2O в уравнении (53) в левую часть. Обозначим произведение KaaH2O через Kд, CH3COOH. Тогда
(54)
Величина Kд называется термодинамической константой диссоциации или сокращенно константой диссоциации.
Вода—тоже электролит, но не сильный, так как слабо диссоциирует на ионы; одновременно она является и растворителем. В связи с этим реакция диссоциации идет по уравнению
H2O + H2O = H3O+ + OH-
На основании закона действия масс имеем(55)
Поскольку концентрация образующихся ионов ОН- и H3O+ очень невелика, активность недиссоциированных молекул воды можно считать не зависящей от степени диссоциации. Перенесем aH2O в левую часть и обозначим произведение KaaH2O через Kд,H2O. Тогда
(56)
Величина Kд, H2O представляет собой термодинамическую константу диссоциации воды, а произведение Kд,H2OaH2O обозначается через Kw, и называется ионным произведением воды:
Kw = aH2OaOH-
Термодинамическая константа диссоциации и ионное произведение воды зависят от температуры. Обычно изменение константы диссоциации с повышением температуры невелико, например для кислот, с повышением температуры от 0 до 20 °С константа диссоциации изменяется всего на 3—8%. Ионное произведение воды в этом же интервале температур возрастает более чем в 6 раз.
Значения термодинамических констант диссоциации слабых кислот, растворенных в воде, проходят через максимум, который для приведенных в таблице кислот лежит в интервале между 0 и 60 °С. Это можно объяснить влиянием двух противоположно направленных воздействий. С одной стороны, всякая диссоциация протекает с поглощением тепла, и, следовательно, при повышении температуры равновесие должно смещаться в сторону большей степени диссоциации. С другой стороны, при повышении температуры диэлектрическая проницаемость воды, служащей растворителем, уменьшается, а это способствует воссоединению ионов. Максимального значения константа диссоциации достигает при той температуре, при которой влияние второго фактора начинает преобладать,
Ионное произведение воды с повышением температуры непрерывно возрастает.
Заменив активности произведениями аналитических концентрации на соответствующие коэффициенты активности, получим, например, пользуясь моляльностью
(57)
Обозначим(58)
Тогда(59)
Совершенно так же можно выразить термодинамическую константу диссоциации через молярность с и соответствующие коэффициенты активности f. Обозначив
(60)
получим
(61)
Выразим общую концентрацию электролита в моль/л через с (молярность), степень диссоциации обозначим через α. Тогда
[СН3СОO-] = сα; [Н3O+] = сα; [СН3СОOH] = с (1 - α)
Уравнение для kc принимает вид
(62)
Последнее равенство является простейшей формой закона разведения, сформулированного Оствальдом в 1888 г. Очевидно, что чем больше kc, тем выше степень диссоциации. Таким образом, величина kc может служить мерой силы кислоты, т. е. мерой кислотности. Для умеренно слабых электролитов, например Н3РO4 (первая ступень), Са(ОН)2, СНСl2СООН, значения kc лежат в пределах от 10-2 до 10-4. Для слабых электролитов, например СН3СОOH, NH4OH, kc = 10-5 — 10-9. При kc<10-10 электролит считается очень слабым. Такими электролитами являются H2O, C6H5OH, HCN.
Если степень диссоциации очень мала, то величиной α можно пренебречь по сравнению с единицей, и формула (46) примет вид
kc = cα2 или α (63)
т. е. степень диссоциации обратно пропорциональна корню квадратному из концентрации электролита.
Если электролит распадается больше чем на два иона, то зависимость kc от степени диссоциации соответственно усложняется. Например, при диссоциации CaCl2 имеем
[Ca2+] = cα; [Cl-] = 2cα и [СаС12] = с (1 - α)
откуда
(64)
Соответственно при малой степени диссоциации
Можно отметить, что для электролитов, распадающихся на два иона, значение kc равно четверти концентрации, при которой α = 1/2.
В разбавленных растворах значения подвижностей U и V незначительно отличаются от предельных значений подвижностей (U ≈ U0 и V ≈ V0), поэтому, разделив выражение (47) на уравнение (48), получим уравнение
(65)
Подставив выражение (49) в формулу (46), получим
(66)
Величина kc является постоянной только для очень разбавленных растворов, коэффициенты активности которых можно считать равными единице. Вообще же kc — величина переменная. Некоторые авторы называют kc классической константой диссоциации, но правильнее её называть классической функцией диссоциации или просто функцией диссоциации.
Если ионная сила раствора достаточно мала, то коэффициент активности недиссоциированной уксусной кислоты fCH3COOH близок к единице и уравнение (60) примет вид:
Kд, CH3COOH = kcfCH3COO- fH3O+ (67)
Величина Kд, CH3COOH в уравнениях (51) и (44), т.е. термодинамическая константа диссоциации, не зависит от концентрации.
Похожие работы
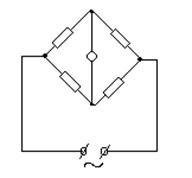
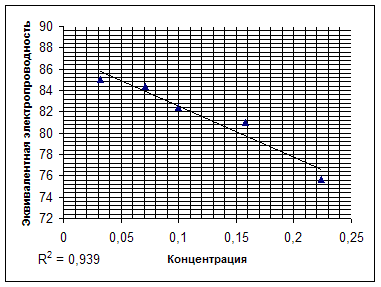
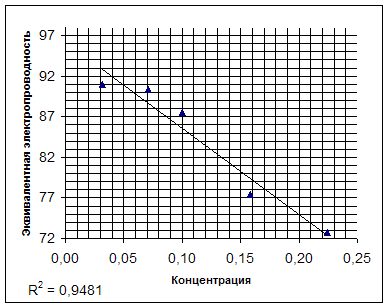
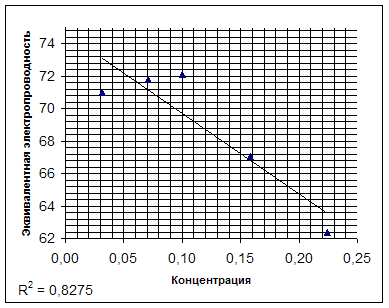
... к проводникам второго рода, для которых характерна ионная проводимость. Цель данной работы заключается в определении эквивалентной электропроводности лизина и установлении зависимости эквивалентной электропроводности от концентрации. Обзор литературы Мерой способности веществ проводить электрический ток является ...
... или кислот; так получают, например, золь гидроксида железа(III), имеющий следующее строение: {[Fe(OH)3]m n FeO+ · (n–x)Cl–}x+ x Cl– 4.2.2 Агрегативная устойчивость лиофобных коллоидов. Строение коллоидной мицеллы Лиофобные коллоиды обладают очень высокой поверхностной энергией и являются поэтому термодинамически неустойчивыми; это делает возможным самопроизвольный процесс уменьшения ...
... Планка; NA – число Авогадро; - приведенная масса молекулы электролита, г; сi – молярная концентрация ионов (сi= c0); с0 – исходная молярная концентрация электролита. 3. Изоморфизм уравнений При рассмотрении движения в поле вязких сил удобно ввести понятие подвижности b. Подвижность определяется как предельная скорость, приобретаемая телом под действием силы, равной единице, т. ...
... при изучении синтеза новых материалов и процессов ионного транспорта в них. В чистом виде такие закономерности наиболее четко прослеживаются при исследовании монокристаллических твердых электролитов. В то же время при использовании твердых электролитов в качестве рабочих сред функциональных элементов необходимо учитывать, что нужны материалы заданного вида и формы, например в виде плотной керамики ...
0 комментариев