Навигация
Эритроцит - строение и функции
1.1.2. Эритроцит - строение и функции
Кровяные дыхательные пигменты появляются в процессе эволюции одновременно с формированием системы кровообращения. У низших животных они растворены в плазме крови, у высших -осредоточены в специальных клетках крови - эритроцитах. В ходе эволюции количество эритроцитов растет, а их размеры уменьшаются, что ведет к увеличению дыхательной поверхности эритроцитов (Черниговский и др., 1968).
В кровеносном русле при нормальных физиологических условиях эритроцит имеет форму двояковогнутого диска с утолщениями по краям. Форма стойко сохраняется не только целым эритроцитом, но и его стромой после выхождения гемоглобина (гемолиза). Устойчивость формы эритроцита связана с наличием в его строме белка, близкого к миозину, обладающему сократительными свойствами. Строма составляет 10% от объема эритроцита. Она состоит на 10% из липидов, остальную ее часть представляют белки. Фосфолипиды представлены кефалином, лецитином, фосфатидил-холином, сфингомиелином.
При исследовании в световом микроскопе фиксированных мазков, окрашенных панхроматическими методами, нормальный эритроцит (нормоцит) имеет форму диска с небольшим просветлением посередине, оксифилен, т. е. воспринимает кислые красители. Диаметр эритроцита колеблется от 5,0 до 9,0 мкм. Размеры эритроцитов человека различаются в зависимости от пола и возраста, климатогеографических условий проживания (Ткаченко и др., 1994).
Эритроцит является монофазной клеткой, т. е. не имеет эндоплазматических мембран. Снаружи эритроцит окружен белково-липидной мембраной. Он заполнен гемоглобином, молекулы которого вблизи от мембраны расположены упорядоченно, перпендикулярно к ней, а в более глубоких слоях - хаотично. Плоскость “упаковки” молекул гемоглобина в эритроците такова, что даже в центральных частях подвижность его каждой молекулы ограничена пространством в 10 А.
Строение мембраны эритроцита подобна строению других клеточных мембран. Строгая пространственная ориентация липидных молекул в мембране определяет заряд клетки. В физиологических границах рH крови эритроцит заряжен отрицательно (Черниговский и др., 1968).
Цитоскелет эритроцита способен к деформации, что позволяет ему проникать в мелкие каппиляры. Кроме того, эритроциты несут антигены, определяющие группу крови человека.
Эритроциты способны депонироваться в определенных органах. Исследования Barkroft и его школы показали, что селезенка и печень являются главными резервуарами эритроцитов.
По данным Faghraene, Allen и Reene (цит. по Рябов, 1978) резервуаром для эритроцитов являются те части организма, которые содержат эритроцитов больше, чем это необходимо для их тканей, т. о. речь идет не об истинных, а о функциональных резервуарах. Кроме селезенки к ним относятся печень, подкожные сосудистые сплетения и другие части кровообращения.
Разрушение эритроцитов происходит в результате изменения их структуры. Мембраны становятся более ломкими, в результате механические силы циркуляции разрывают их, после чего ретикуло-эндотелиальные клетки фагируют эритроциты. Процесс старения связан с изменением гемоглобиновой молекулы. Ретикуло-эндотелиальные элементы не участвуют в разрушении эритроцитов, а лишь являются местом переработки эритроцитарных остатков (Серафимов-Дмитров, 1974).
При различных анемиях, вне зависимости от генеза, может наблюдаться пойкилоцитоз (изменение формы эритроцитов). Например серповидные клетки появляютя в периферической крови при серповидноклеточной анемии. Микросфероциты обнаруживаются при наследственном сфероцитозе (болезни Минковского-Шоффара). Овалоциты - при мегалобластической анемии, железодифецитной анемии. Акантоциты - тяжелые болезни печени и -липопротеинемия (поверхность клетки имеет зубчатую форму). Дегмациты часто содержат тельца Гейнца и наблюдаются при гемолитической анемии, вызванной отравлением окислителями. И многие другие формы эритроцитов.
1.1.2.1. Дыхательный пигмент - гемоглобин
95% массы эритроцита занимает Hb. Гемоглобин - это хемопротеид состоящий из гема и глобина (белка). В геме Fe устойчиво связано с атомами азота двух пирольных ядер и неустойчиво с еще двумя атомами азота, а оставшаяся свободная валентность связана мобильно с атомом азота имидазольной группы гистидина гемоглобиновой молекулы.
Перенос О2 осуществляется путем связывания одного атома кислорода лабильной связью железа с гистидином. При связывании кислорода гемоглобином образуется оксигеноглобин (HbО2), где четыре молекулы кислорода связываются с одной молекулой гемоглобина, т.к. в ней содержится 4 гемовых кольца, связанных с молекулами белка (Серафимов-Дмитров, 1974).
Глобиновая часть представляет собой белковое тело, состоящее из четырех полипептидных цепей. Синтез глобина начинается с первых стадий и, постепенно убывая, продолжается в процессе созревания эритроцита, а синтез гема наиболее интенсивен на стадии позднего эритробласта (Коржуев, 1964).
Синтез гемоглобина представляет собой сложный процесс. В нем участвуют два простых исходных соединения: аминокислота глицин и сукцинил-коэнзим А - промежуточный продукт цикла трикарбоновых кислот. В реакцию вступают восемь молекул сукцинил-коэнзима А. Глицин служит источником всех атомов азота пирольных колец, а так же части углеродных атомов. Остальные атомы углерода гема принадлежат сукцинилу (остатку янтарной кислоты).
Синтез протопорферина происходит в митохондриях. Туда же из плазмы поступает железо, переносчиком которого является белок трансферрин. Синтезированный гем выходит в цитоплазму, где соединяется с глобином, синтезированном на полирибосомах (Ленинджер, 1974).
Образованный гемоглобин - тетрамер, состоящий из двух -глобиновых цепей, содержащих 141 аминокислотный остаток и двух цепей глобинов другого типа (, , , , ), состоящих из 146 аминокислотных остатков (Денисов и др., 1998). Гемоглобин синтезируется главным образом в ретикулоцитах.
В норме в крови взрослого человека присутствует три формы гемоглобина:
HbA состоит из двух и двух цепей и состовляет 96 - 97% от общего количества гемоглобина;
HbA2 - 2,5 - 3% (2 и 2 цепи) - известно около 20 мутаций цепи, которые снижают функциональные возможности и пластичность эритроцитов;
HbF (фетальный гемоглобин) - основной гетерогенный гемоглобин эритроцитов внутриутробного периода. Состоит из двух и двух -глобиновых цепей. После рождения резко снижается содержание фетального гемоглобина в крови и у взрослого человека составляет 0,1 - 1%. Гемоглобин F обладает большим сродством к кислороду, чем HbA. Известно более 60 мутаций цепи.
Кроме этих форм выделяют эмбриональные типы гемоглобина:
Hb Gower-1 - минорный компонент эмбрионального гемоглобина, находят на ранних стадиях развития плода. Состоит из двух и двух -цепей. По мере развития плода замещается на Hb Gower 2, Hb Portland, а позднее на Hb F.
Hb Gower 2 ( 2 2) - основной компонент эмбрионального Hb, находят на ранних стадиях развития плода.
Hb Portland - форма эмбрионального гемоглобина, содержащая цепь Hb Gower 1 и цепь HbF (2 2) - экспрессия прекращается к 3 месяцу внутриутробного развития.
Могут образовываться и аномальные формы Hb:
Hb Rainier - аномальный гемоглобин, у гетерозигот полицитемию из-за высокого сродства к кислороду.
HbS - серповидноклеточный гемоглобин. Мутация происходит в шестом положении -цепи, у гетерозигот наблюдаются серповидноклеточные эритроциты (если HbS от 20 до 45%, а остальной HbA, то анемии нет), а у гомозигот - серповидноклеточная анемия (HbS свыше 75%).
HbM - группа аномальных гемоглобинов, у которых замещение одной аминокислоты способствуют образованию метгемоглобина (хотя активность метгемоглобинредуктазы нормальна). Гетерозиготы имеют врожденную метгемоглобинемию, а гомозиготы - летальный исход.
Hb Lepore - группа аномальных гемоглобинов у которых цепь - нормальна, а другие цепи имеют N-конец цепи в сочетании с С-концом цепи. У гетерозигот 10% Hb Lepore, нормальное содержание HbA2 и умеренно повышенное содержание HbF - характерна тяжелая анемия.
Существуют и другие формы аномальных гемоглобинов ( HbI, HbH, Hb Барта и т. д.) (Денисов и др., 1998).
Расщепление Hb начинается в макрофагах. Освободившийся из эритроцитов гемоглобин расщепляется на протеиновую часть, которая включается в белковый метаболизм, а освободившийся гем распадается на билевердин и билирубин. При этом происходит отщепление атома железа, который в костном мозге используется для синтеза новых молекул гемоглобина. Желчные пигменты соединяются с альбумином и этот комплекс поступает в печеночные клетки, под действием глюкоронидтрансферазы реагируют с уридинфосфоглюкороновой кислотой и образуется билирубиндиглю-
коронид. Он растворим в воде и с желчью выделяется в кишечник, где под влиянием кишечной микрофлоры преобразуется в стеркобилин и выводится с калом (Алексахина, Зайцева, 1989).
Похожие работы
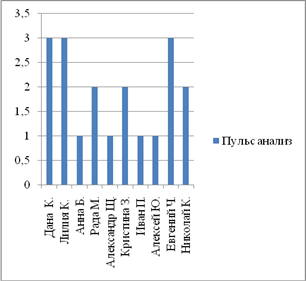
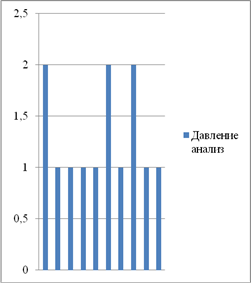
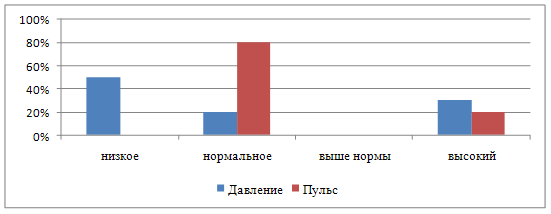
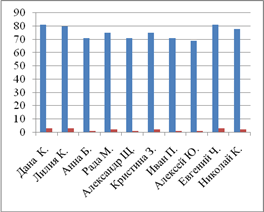
... 10 % пациентов. Результаты представлены графически (приложение 8). 2. Автором выпускной квалификационной работы был проведен хронометраж пульса и давления. Цель: выявить влияние неблагоприятных природных факторов на работу сердечно-сосудистой системы. Осуществлялась оценка параметров организма испытуемых в благоприятный (солнечная и геомагнитная активность в норме, температура воздуха ...
0 комментариев