Навигация
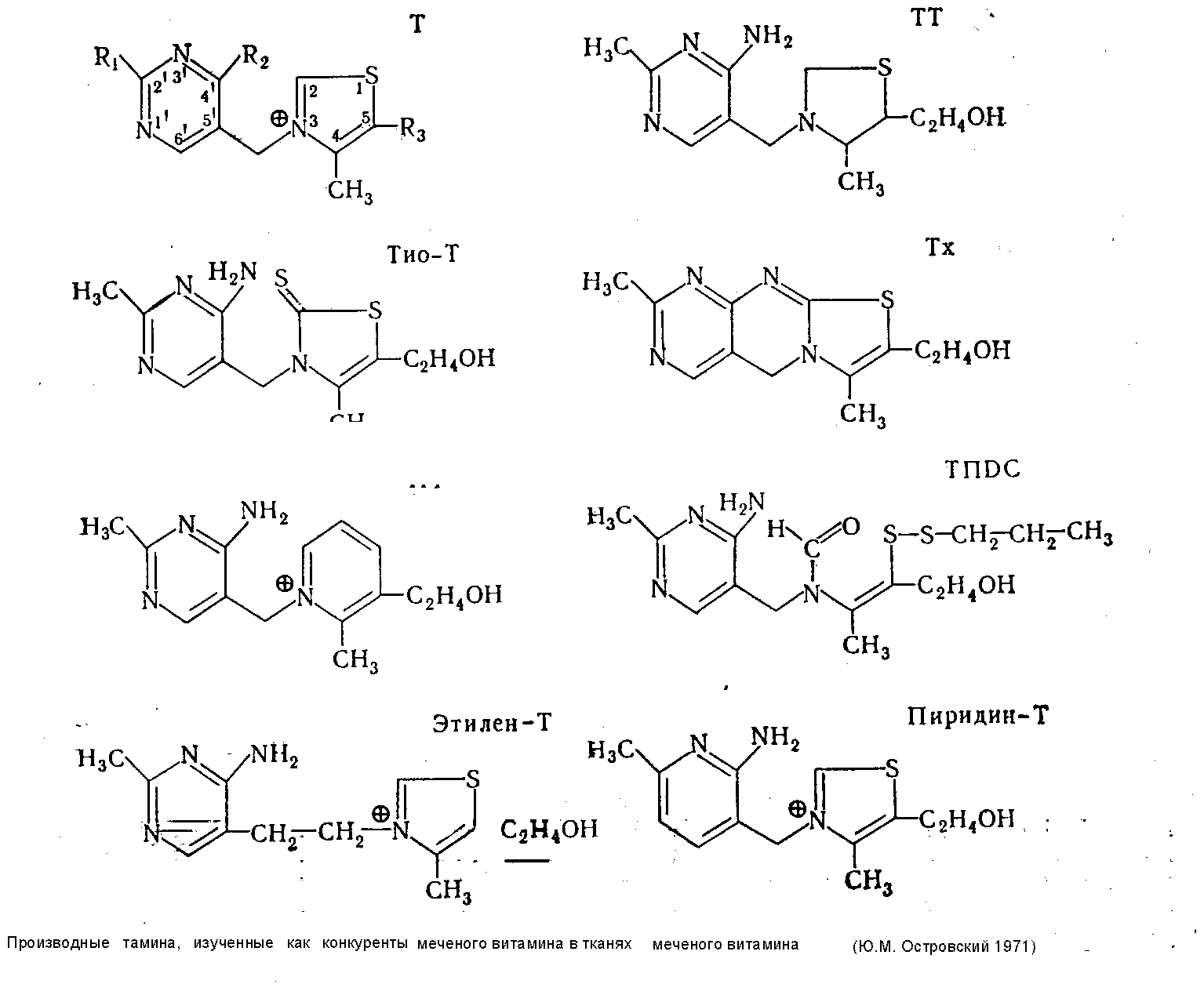
Роль отдельных группировок в молекуле тиамина для его связывания в тканях
4.2 Роль отдельных группировок в молекуле тиамина для его связывания в тканях.
За последние годы синтезировано более десятка новых производных тиамина (смешанные дисульфиды, О-бензольные производные и др.), широко внедряемых в лечебную и профилактическую практику. Преимущества новых витаминных препаратов, как правило, выявлялись чисто эмпирически в связи с тем, что до настоящего времени мы не располагаем достаточными сведениями о молекулярных механизмах ассимиляции тиамина, о характере его взаимодействия со специфическими (ферменты) и неспецифическими (осуществляющими транспорт витамина) белками. Необходимость точных представлений в этом вопросе диктуется и широкими перспективами использования антивитаминов тиамина (ампрол, хлоротиамин, деокситиамин) для лечебных целей (см. ниже).
Работы по синтезу новых производных тиамина с заранее заданными физико-химическими свойствами, обусловливающими возможности целенаправленного воздействия на обменные процессы в организме, немыслимы без конкретных представлений о роли отдельных групп атомов витамина и его производных в этой области. Значение пирофосфатного радикала для специфической потеидизации ТДФ в составе соответствующих ферментов уже отмечалось выше. В последние годы становится все более очевидным участие тиамина в других реакциях, не имеющих ничего общего с коферменными функциями витамина. Разнообразию активных группировок в молекуле тиамина соответствует каждый раз особая форма- претеидизации, блокирующая одни и обнажающая одновременно другие, важные для соответствующей функции, участки молекулы витамина (Ю. М. Островский, 1971). Действительно, первый тип протеидизации (через пирофосфатный радикал) отвечает коферментной функции и оставляет свободными, доступными для субстрата 2-й углерод тиазола и аминогруппу пиримидинового компонента. С другой стороны, очевидно, что участие витамина в окислительно-восстановительных реакциях или в процессах перефосфорилирования должно сочетаться с исключением возможности одновременного функционирования его как кофермента, так как в первом случае необходима деполяризация и раскрытие тиазолового цикла, а во втором — свободное положение фосфорилированного оксиэтильного радикала. Поскольку 80—90% тиамина, присутствующего в тканях, освобождается лишь при кислотном и ферментативном гидролизе, можно считать, что все связанные формы витамина находятся в протеидизированном, т. е. связанном с белками, состоянии.
Представление о значении отдельных участков молекулы тиамина в этом процессе легко получить, определяя степень связывания тканями меченного по сере (S35) витамина и некоторых его производных, лишенных тех или иных активных центров, например аминогруппы — окситиамин (окси-Т), аминогруппы и оксиэтильного радикала — хлорокситиамин (ХОТ), четвертичного азота в тиазоловом цикле тетрагидротиамин (TТ) Некоторые ограничения на интерпретацию данных, полученных таким образом в короткие сроки опыта, накладывают физиологические механизмы, транспорта и экскреции вводимых соединений, в связи с чем дополнительно приходится исследовать также выведение витамина и самих меченых соединений с мочой. С другой стороны, результаты, получаемые в длительные сроки (24 часа), почти полностью соответствуют только представлениям о протеидизированной части витамина, а на основании рассмотрения конкурентных взаимоотношений между различными упомянутыми выше мечеными и другими немечеными производными витамина можно последовательно исключать роль отдельных атомов или группировок в механизмах фиксации тиамина тканями.
4.3 Коферментные функции тиаминдифосфата.
Известно значительное количество различных реакций, катализируемых ТДФ. Однако все их можно свести к нескольким типичным вариантам: простое и окислительное декарбоксидирование -кетокислот, ацилоиновая конденсация, фосфорокластическое расщепление кетосахаров. Ферментные системы, принимающие участие в этих реакциях по-видимому, едины в основных принципах своего действия; различна лишь последующая судьба «активного альдегидного осколка», возникающего на первых этапах процесса. Успехи, достигнутые в течение последних лет в изучении превращений -кетокислот (С. Е. Северин, 1964; А. А. Глемжа, 1964), позволили четко представить как роль собственно декарбоксилирующего фрагмента полиферментного комплекса дегидрогеназы, содержащего ТДФ, так и последовательность всех других, связанных с ним реакций:
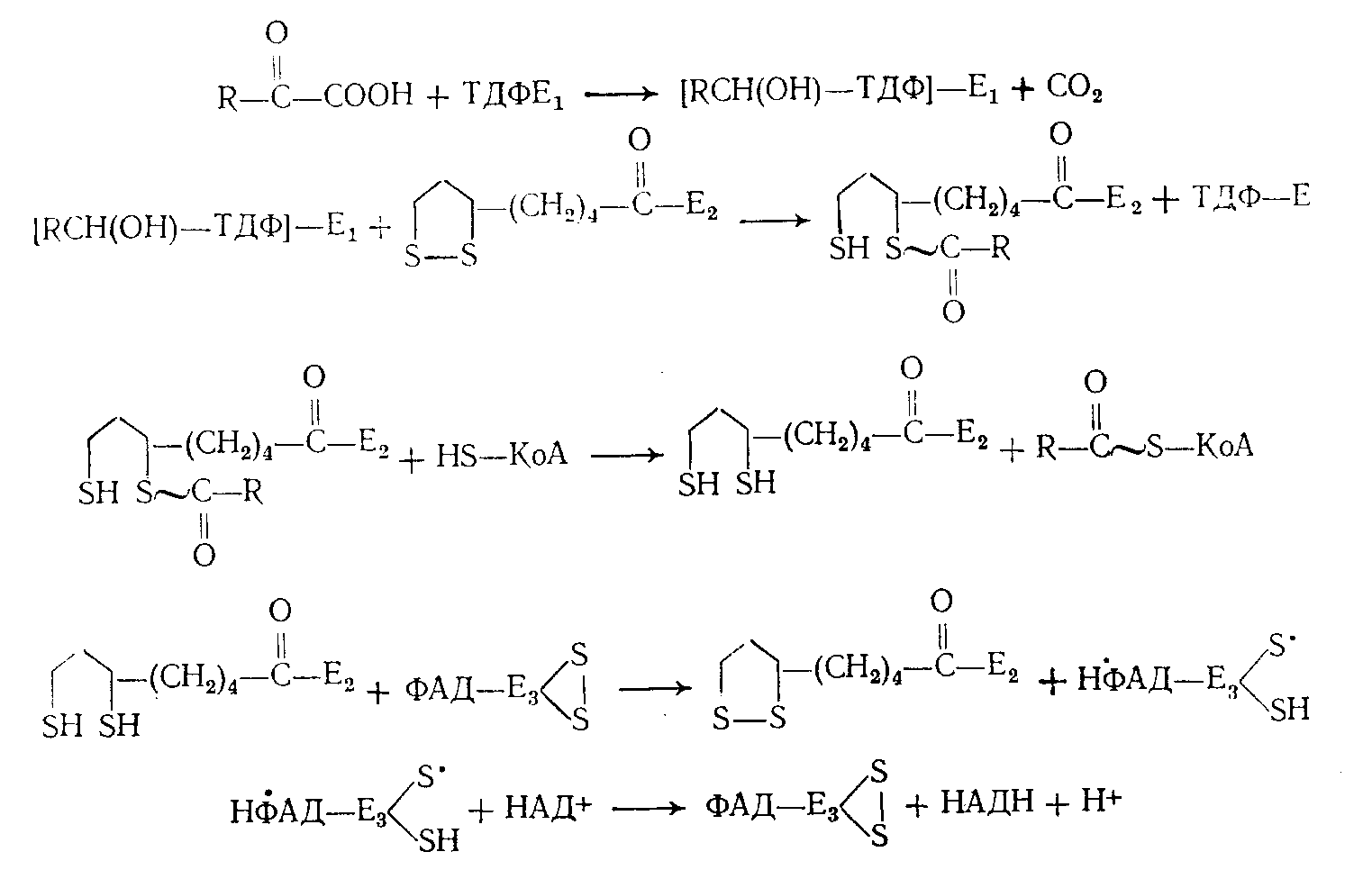
В системе транскетолазы (ТК) «активный альдегидный» осколок, очевидно, будет представлен гликолевым радикалом, переносимым от соответствующих источников (ксилулозо-5-фосфат, фруктозо-6-фосфат, оксипируват и др.) на различные акцепторы (рибозо-5-фосфат, эритро-зо-4-фосфат, глюкозо-6-фосфат). В фосфокетолазной реакции «активный гликолевый» радикал превращается непосредственно в ацетилфосфат.
Значительные успехи в выяснении механизма каталитического действия ТДФ были достигнуты в результате исследований, проведенных в двух основных направлениях: создание модельных неферментативных систем и введение в ферментные системы различных аналогов или антагонистов тиамина. Используя первый путь, удалось показать, что витамин и в нефосфорилированном виде способен при определенных условиях в отсутствие белка катализировать реакции декарбоксилирования, образования ацетона, дисмутации диацетила. Различными вариантами опытов, в которых коферментная активность ТДФ сравнивалась с активностью антиметаболитов витамина или изучалась с добавлением соли Рейнеке, бромацетата, пара-хлор-ртуть-бензоата и других соединений, показано, что каталитически наиболее важными группами в молекуле тиамина являются: сера, четвертичный азот тиазолового кольца, аминогруппа в положении 4 пиримидинового: кольца, второй углеродный атом тиазола (2-С-Тз), метиленовый мостик. Можно считать устоявшимся представление, что часть перечисленных выше активных центров (сера, азот, метиленовый мостик) крайне необходима только для поддержания определенной структуры и создания соответствующей электронной плот-ности-(Б. Пюльман, А. Пюльман, 1965) у второго углеродного атома тиазола (2-С-Тз), который является главным каталитическим центром. Спорными и неопределенными пока являются представления о значении аминогруппы пиримидинового компонента.
Некоферментная активность тиамина и некоторых его производных.
За последние 20 лет наряду выяснением механизма основных реакций, в которых каталитическую роль играет ТДФ, стали накапливаться данные о высокой биологической активности других некоферментных производных тиамина. Отчетливо наметились два направления исследований: возможное, участие различных фосфорных эфиров витамина в активном переносе богатых энергией фосфатных групп (ангидридная связь в ТДФ макроэргическая) и вероятность вмешательства тиамина в окислительно-восстановительные реакции В связи с тем что неизвестны специфические тиаминсодержащие ферментные системы, причастные к регуляции упомянутых выше процессов, наблюдаемые в этой сфере обмена эффекты витамина можно рассматривать как проявление его неспецифических функций.
Тиаминофосфаты (ТФ).
После разработки доступных методов получения ТДФ последний стали широко испытывать при различных заболеваниях в клинических условиях. Внутривенное введение 100—500 мг ТДФ при диабетическом ацидозе увеличивало количество пирувата, образующегося из глюкозы. Эффект аналогичного характера наблюдался при диабете после введения АТФ или фосфокреатина. Инкубация цельной крови с Р32н в присутствии Зх10-3М тиамина сопровождалась ускоренным внедрением метки в промежуточные продукты гликолиза (фруктозо-1,6-дифосфат, фруктозо-6-фосфат). Особенно заметно во времени, по сравнению с контролем без витамина, возрастала радиоактивность триозофосфатов. По данным Л. Н. Кузнецовой, Е. В. Лахно и Р. В. Чаговец (1953), в мышцах при утомлении и отдыхе распад и ресинтез ТДФ происходят примерно по тем же закономерностям, которые известны для АТФ и фосфокреатина. Характерными были изменения во время отдыха, когда количество ТДФ превышало исходный уровень до утомительной работы. Авторы не рассматривают причин усиленного распада ТДФ во время сократительной деятельности мышц, и вряд ли это возможно с позиции известных коферментных функций ТДФ. Торможение функциональной активности печени (введение ССЦ, гипоксия), по-видимому, за счет снижения расхода, сопровождается накоплением в органе ТФ. Наконец, совместное с глюкозой скармливание больших количеств ТДФ крысам сопровождалось заметным (на 69%) повышением уровня АТФ в печени.
Группа японских исследователей подробно изучила на циклофоразной системе внедрение Р32 из меченого ТДФ в немеченый АТФ. Перенос метки был в 3—4 раза больше в присутствии Р32-ТДФ, чем в присутствии неорганического Р32н, хотя система и во втором случае содержала столько же ТДФ. Если циклофоразную систему выделяли из печени страдающих от недостаточности тиамина крыс, то внедрение Р32 в АТФ из меченого ТДФ превышало контроль в 8—10 раз. Независимость внедрения Р32 в АТФ от эстерификации неорганического фосфата подтверждалась и тем, что ДНФ (10-4М), снижавший интенсивность окислительного фосфорилирования в 5—10 раз, не влиял на процесс переноса метки от ТДФ к АТФ.
Еще более интересными представляются результаты сравнительного изучения физико-химической и «субстратной» разнозначности концевых фосфатов АТФ и ТТФ. Оба соединения одинаково гидролизуются картофельной апиразой и кристаллическими препаратами миозина. Макроэргический характер фосфатных остатков в ТФ побудил ряд авторов исследовать роль этих соединений в начальных реакциях углеводного обмена. Пекарские дрожжи (Kiessling, 1957) в присутствии Р32н, и глюкозы интенсивно накапливают метку вначале преимущественно в -фосфате ТТФ и АТФ, а затем в α- и β-фосфатах. Удельная активность ТТФ в определенных условиях опыта может уравниваться с таковой для АТФ, что рассматривается как выражение причастности ТФ к переносу лабильных фосфатов при обмене глюкозы. Действительно, на белковых препаратах из дрожжей -Р32 ТТФ переносится на глюкозу в присутствии АДФ. Смесь ТФ (около 70% ТТФ), неактивная сама по себе, в присутствии АТФ стимулирует потребление глюкозы гексокиназой, полученной из миокарда, но не из скелетных мышц. Митохондрии содержат значительные количества ТФ, которые могут быть удалены на ѕ без заметного нарушения окисления ПК или сукцината. Сами эти ТФ захватывают до 75% Р32н по отношению к АТФ, а классический разобщающий яд ДНФ тормозит образование АТФ в большей степени, чем ТФ. Введение животным окси-Т, в зависимости от характера субстратов дыхания, может нарушать в митохондриях отдельно окислительные и фосфорилирующие реакции, а на интактных митохондриях, инкубируемых в отсутствие АТФ, добавление ТФ (особенно ТМФ) достоверно повышает эстерификацию неорганического фосфата. В последнее время установлено, что введение животным больших доз ТДФ уже через несколько часов значительно, (иногда в 2 раза) повышает в тканях содержание лабильных фосфорных соединений. Интересной представляется заметно большая эффективность ТМФ в ряде опытов, что, возможно, связано со своеобразным отношением этого производного тиамина к мембранам или обусловлено более легким его превращением в ТТФ. Есть основания полагать, что имеются определенные особенности взаимодействия ТФ с фосфорилирующими реакциями в различных тканях. В нервной ткани, например, с превращением ТФ ряд авторов связывают физиологические акты проведения возбуждения (Muralt, 1962) и транспорт ионов натрия через мембраны.
4.6 Свободный тиамин и его производные. Введение животным антиметаболитов витамина — окси-Т и ПТ — вызывает различную картину нарушений в обмене и в физиологических функциях, что позволило Д. Вулли (1954) предположить вероятность существования у тиамина нескольких различных или даже независимых друг от друга функций. Различие между этими антиметаболитами с химической точки зрения сводится к исключению тиолдисульфидных превращений у ПТ и три-циклических по типу тиохрома (Тх) у окси-Т. Возможность каталитического действия тиамина на уровне окислительно-восстановительных реакций в обмене давно допускают и критикуют разные авторы. Действительно, различная обеспеченность витамином сильно влияет на активность ряда окислительных ферментов или содержание в крови восстановительных форм глютатиона. Витамин обладает антиоксидантными свойствами в отношении аскорбиновой кислоты, пиридоксина и легко взаимодействует с оксигруппами полифенолов (Takenouchi, 1965). Дигидро-Т частично окисляется в тиамин дрожжами и бесклеточными экстрактами, кристаллическими препаратами пероксидазы, тирозиназы и неферментативно при взаимодействии с кристаллическим убихиноном, пластохиноном, менадионом.
5. Физиологическое значение витамина В1 состоит в мощном регулирующем воздействии его на отдельные функции организма и, в первую очередь, на обменные процессы. Сущность же этого воздействия заключается в том, что тиамин участвует в обмене веществ в качестве коэнзима. Особенно важную роль витамин В1 играет в углеводном обмене.
Свою биологическую активность тиамин приобретает в кишечнике, печени и почках в процессе присоединения фосфорной кислоты (фосфорилирования).
Значение витамина В1 длянормального обмена углеводов и состоит прежде всего в том, что фосфорное производное тиамина – дифосфотиамин (кокарбоксилаза) в виде простетической группы входит в состав карбоксилазы – фермента, который с участием липоевой кислоты осуществляет реакции декарбоксилирования (отщепление СО2) пировиноградной и других α-кетокислот с последующим их распадом.
Если в организме мало тиамина, то дальнейший распад пировиноградной кислоты задерживается. Это подтверждается повышением уровня пировиноградной кислоты в условиях В1-витаминой недостаточности. Наряду с этим показано, что уровень пировиноградной кислоты может повышаться и при других патологических процессах, сопровождающихся нарушением углеводного обмена, как, например при болезни Боткина, сахаром диабете и др. Витамин В1 снижает уроень пировиноградной кислоты и у здоровых людей, причем такой же эффект выявлен и после предварительной нагрузки глюкозой. Проведено также изучение влияния витамина В1 на процессы усвоения сахара мышцами в патологических условиях. По данным исследования артерио-венозной разницы в содержании сахара при двойной сахарной нагрузке до и после введения витамина В1 (20мл) выявлено положительное значение этого витамина для регуляции нарушенных процессов углеводного обмена (З.В. Новицкая, 1950).
Особого внимания заслуживает значение витамина В1 для функционального состояния центральной нервной системы и мышечной деятельности. Это становится понятным, если учесть, что центральная нервная система почти всю свою энергию черпает из углеводов, в обмене которых тиамин принимает активное участие. Нарушение В1 – витаминного баланса лишает центральную нервную систему возможности эффективно использовать глюкозу при одновременном накоплении здесь промежуточных продуктов обмена (пировиноградная, молочная кислота и др.) токсически влияющих на мозг.
Тиамин является важным фактором в передаче нервных импульсов – тормозит образование и инактивирует холинэзтеразу, которая гидролизирует ацетилхолин. Этим самым тиамин косвенно усиливает активность ацетилхолина как передатчика нервного возбуждения.
Последующие исследования установили, что В1 – авитаминоз (полиневрит) всегда сопровождается глубокими нарушениями белкового обмена в силу уменьшения активности различных ферментов, принимающих участие в этом обмене.
Особого внимания заслуживает участие тиамина в синтезе нуклеиновых кислот. Дефицит его так же приводит к нарушению гемопоэза.
Таким образом, можно прийти к общему выводу, что витамин В1, являясь мощным регулятором углеводного обмена, в то же время имеет важное значение и для обмена белков. За последнее время получены отчетливые данные о связи этого витамина также с жировым, минеральным и водным обменом.
Кроме того, тиамин оказывает так же выраженное влияние на функциональное состояние отдельных органов и систем организма. Связанные с гипо- и авитаминозом нарушения центральной нервной системы, в свою очередь, ведут к расстройству сердечно-сосудистой системы, эвакуарно-секретной функции желудка и кишечника и эндокринной системы.
Тиамин обладает относительно низкой фармокологической активностью. Все приведенные факты заставляют думать, что описанные для витамина многочисленные положительные эффекты разрешаются каким-то образом на более специфически связанных с ним обменных уровнях или в системах, которые пока ускользают от контроля.
План:
Биотин…………………………………………………………..1
Исторические сведения……………………………………..1
Химические и физические свойства биотина………………1-3
Аналоги и ингибиторы……………………………………………3-4
Распространение биотина в природе…………………………..5
Биосинтез биотина……………………………………… 5-7
Обмен биотина в организме…………………………………….7-9
Участие биотина в обмене веществ и механизм действия………………………………………………………9-12
Взаимодействие с другими витаминами………12-13
Потребность организма в биотине……..…………….13
Проявление недостаточности биотина………..13-14
8. Профилактическое и лечебное применение биотина….14-15
Тиамин…………………………………………………………..16
Исторические сведения……………………………….16
Химические и физические свойства витамина …16-17
Распространение витамина В1, в природе………..18
Обмен тиамина в организме………………………18-20
Образование тиаминфосфатов (ТФ)..………..20-21
Роль отдельных группировок в молекуле тиамина для его связывания в тканях………………….21-22
Коферментные функции тиаминдифосфата…22-23
Некоферментная активность тиамина и некоторых его производных……………………………..………23
Тиаминофосфаты (ТФ)………………………...…23-24
Свободный тиамин и его производные..………24-25
5. Физиологическое значение.…………………………25-26
Список использованной литературы
Витамины. Каталог. М., 1957
Крыжановская И.И. Витамин В1 при хронической недостаточности кровообращения. Киев 1967.
Виноградов В.В. Гормональные механизмы метаболического действия тиамина Минск. 1984.
Островский Ю.М. Активные центры и группировки в молекуле тиамина. Минск. 1975.
Познанская А.А. Витамины М. 1974.
Биохимия и физиология витаминов под ред. Проф. М.М. Сисакина М. 1950.
Тиамин. Обмен, механизм действия (сборник статей) отв. Ред. А.А. Титаев. М. 1978.
Островский Ю.М. Тиамин. Минск 1971.
Министерство здравоохранения Р.Ф.
Ярославская Государственная Медицинская Академия
Кафедра биологической и биоорганической химии
Р Е Ф Е Р А Т
Тема: «Строение, свойства и биологическая роль биотина и тиамина.»
Выполнила:
Студентка I-го курса
13-ой группы, пед. Факультета
Бородулиной Е.А.
Руководитель:
Хохлова О.Б.
Ярославль
Похожие работы
... энергии затруднено. Гетероферментативное молочнокислое брожение — процесс более сложный, чем гомоферментативное: сбраживание углеводов приводит к образованию ряда соединений, накапливающихся в зависимости от условий процесса брожения. Одни бактерии образуют, помимо молочной кислоты, этиловый спирт и углекислоту, другие — уксусную кислоту; некоторые гетероферментативные молочнокислые бактерии могут ...
... два других отдела, отделенных мембраной, пирреллюлозому или рибоплазму, которая содержит рибосомы и связанные белки, и свободный от рибосом парафоплазму (Glockner, 2003). 3. Характеристика общих свойств микроорганизмов Микроорганизмы - это организмы, невидимые невооруженным глазом из-за их незначительных размеров. Этот критерий - единственный, который их объединяет. В остальном мир ...
... – переносят в кишечник новорожденного железо, витамины и другие важные соединения. Сывороточный белок α-лактоглобулин имеет специфическую функцию: он необходим для процесса синтеза лактозы. Казеин. Среднее количество его в молоке составляет 81% от общего содержания белков в молоке. Химически чистый казеин – белое аморфное вещество без запаха и вкуса – практически не растворяется в воде. ...
... России страдает от недостатка в питании витаминов и других функциональных веществ. Все большее распространение получают различные заболевания, снижается средняя продолжительность жизни. Химический состав плодов и овощей отличается большим разнообразием, он определяет цвет, вкус, запах, пищевую ценность продукта, сохраняемость и функциональные свойства. Энергетическая ценность большинства видов ...

0 комментариев