Навигация
Участие биотина в обмене веществ и механизм действия
6. Участие биотина в обмене веществ и механизм действия
К 1958—1959 гг. накопились данные, которые указывали на участие биотина в реакциях карбоксилирования. Установлено, что при биотиновой недостаточности нарушаются следующие функции печени животных:
синтез цитруллина из орнитина, МН3 и С02, включение CО2 в пурины, карбоксилирование пропионовой кислоты, приводящее к образованию янтарной кислоты, включение С02 в ацетоуксусную кислоту. Однако механизм действия биотина в этих реакциях оставался невыясненным. Данные опытов с 2-C14-биoтинoм исключали возможность того, что С-атом уреидной группировки биотина переносится в качестве остатка угольной кислоты. Одним из обстоятельств, из-за которых подвергалась сомнению функция этого витамина как кофермента карбоксилирования, было (описанное в разное время) участие биотина в реакциях, в которых не происходило ни включения, ни отщепления С02. Так, было обнаружено влияние биотина на дезаминирование аспарагиновой кислоты, серина и треонина и участие его в синтезе жирных кислот. Первые четкие доказательства коферментной функции биотина в реакции карбоксилирования появились в работах, посвященных именно синтезу жирных кислот. В этих работах отмечалось, что биотин является коферментом ацетил-КоА-карбоксилазы, фермента, осуществляющего карбоксилирование ацетил-КоА с образованием малонил-КоА—первую стадию синтеза жирных кислот (Wakil, 1958). К этому времени были получены доказательства существования еще одного биотинфермента, а именно (З-метил-кротонил-КоА-карбоксилазы (Lynen, Knappe, 1959). Все известные в настоящее время биотиновые ферменты катализируют два типа реакций:
Реакции карбоксилирования или фиксации С02, сопряженные с расщеплением АТФ и протекающие согласно уравнению:
АТФ +
НСОз + RH![]() R—СОО-
+ АДФ + Фнеорг.
R—СОО-
+ АДФ + Фнеорг.
| Реакции | Источник фермента |
| Ацетил-КоА + С02+ АТФ Я-Метилкротонил-КоА + С02 + АТФ Пропионил-КоА + С02 + АТФ Бутирил-КоА+С02 + АТФ Пируват + С02+ АТФ | Печень голубя Микробактерии Сердце и печень свиньи Мышцы и печень голубя Печень голубя |
II. Реакции транскарбоксилирования, протекающие без распада АТФ, при которых карбоксилирование одного субстрата осуществляется при одновременно протекающем декарбоксилировании другого соединения:
R1—COO-
+ R2H![]() R1H
+ R2—
COO-
R1H
+ R2—
COO-
Поскольку все приведенные реакции являются обратимыми, возможен обратимый биосинтез АТФ. Во всех этих случаях имеет место включение С02 в реактивное α-подожение ацил-КоА или винилгомоло-гичное ему положение (при карбо^силировании β-метилкротонил-КоА).
К началу 60-х год5В были выделены и изучены карбоксилазы, осуществляющие указанные превращения —В 1960 г. установлено участие биотина в реакции транскарбоксилирования при исследовании синтеза пропионовои кислоты
СНз—СН—СО~S—КоА
+ СНз—СО—СООН
![]()
![]()
СООН
![]() СНз-СНа—СО~S-КоА
+ НООС-СН2—СО—СООН
СНз-СНа—СО~S-КоА
+ НООС-СН2—СО—СООН
Биотиновые ферменты представляют собой олигомеры с большим молекулярным весом (порядка 700000) и, как правило, содержат 4 моля связанного биотина на 1 моль фермента, поэтому кажется вероятным, что они состоят из 4 субъединиц с молекулярным весом 175000, каждая из которых содержит одну молекулу биотина.
В работах Lynen (1964) расшифрован механизм участия биотина в реакциях карбексилирования. Установлено, что реакции карбоксилирования являются двухстадийными. Первая стадия сводится к образованию «активной С02» в форме С02~биотинфермента:
АТФ + Н
С0-2+
биотинфермент
![]() АДФ
+ Фнеорг. + С02~биотинфермент.
АДФ
+ Фнеорг. + С02~биотинфермент.
Вторая стадия заключается в переносе «активной С02» на акцептор:
С02~биотинфермент
+ R2H
![]() биотинфермент
+ R2—
С00-
биотинфермент
+ R2—
С00-
Аналогичный двух стадийный механизм предложен и для реакций транскарбоксилирования:
R1
—С00-
+ биотинфермент
![]() С02
~биотинфермент
R2H;
С02
~биотинфермент
R2H;
С02~биотинфермент
+ R2H![]() R2—
С00-
+
биотинфермент.
R2—
С00-
+
биотинфермент.
После установления существования «активной С02» в виде С02~биотинфермента установлен характер связи между С02 и биотином. Этому способствовало открытие того факта, что β-метилкротонил-КоА-карбоксилаза способна карбоксилировать свободный биотин, переводя его в карбоксибиотин. В дальнейшем меченый карбоксибиотип был выделен в опытах с С14-бикарбонатом и идентифицирован как Г-М-карбоксибиотин. Его структура была подтверждена химическим синтезом. К атому времени уже было известно, что в биотиновых ферментах карбоксильная группа биотина соединена с ε-NH2-группой лизина ферментного белка ковалентной связью. На основании этих данных предложена структура С02~биотинфермента.
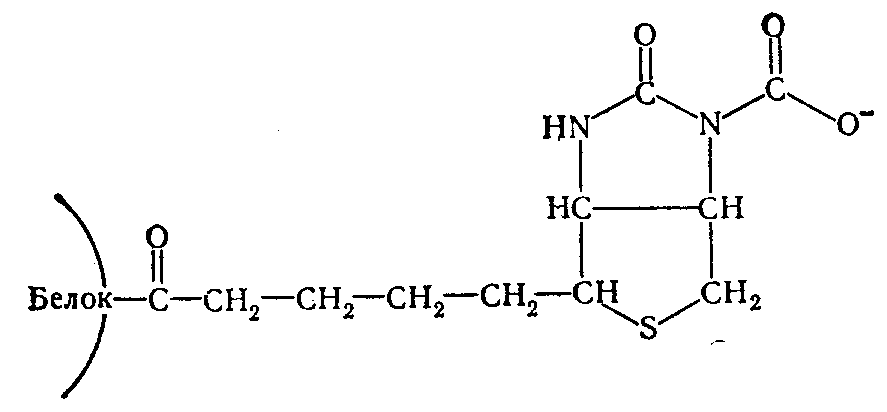
Эта структура получила ряд экспериментальных подтверждений и в настоящее время является общепринятой для всех биотиновых ферментов. Реакционная способность углекислоты, связанной с биотином, находит выражение в энергетических взаимоотношениях. Величина свободной энергии распада С02~биотинфермента равна 4,74 ккал/моль, что дает основание причислить С02~биотинфермента к «богатым энергией» соединениям.
Исключительно большой интерес представляет совершенно неизученная проблема регуляции активности биотинсодержащих ферментов и организме. В этой связи особенно важны исследования по биосинтезу молекулы биотина и образованию холоферментов из биотина и соответствующего ферментного белка. Данные по первому вопросу изложены в разделе «Биосинтез». Что касается образования холофермента, то можно считать установленным, что во всех биотиновых ферментах био-тнн связан с ε-аминогруппой лизина. Этот способ связи экспериментально доказан почти для всех карбоксилаз и метилмалонил-КоА-оксалоаце-таттранскарбоксилазы. Недостаточные по биотину клетки Propionibacterium shcemanii содержат апофермент и специфическую синтетазу, которая катализирует при использовании АТФ соединение биотина с апоферментом, приводящее к образованию активного холофермента траискарбокснлазы. Необходимыми кофакторами этой реакции являются АТФ и Mg2+. При использовании очищенных ферментов удалось доказать, что образование холотранскарбоксилазы происходит в два этапа, причем промежуточным соединением является биотиниладенилат (R-CO-5'-AMФ):
Mg2+
I. АТФ
+ R— С02Н
+ синтетаза![]() R-СО-5’-
АМФ
-
синтетаза
+ пирофосфат
R-СО-5’-
АМФ
-
синтетаза
+ пирофосфат
(биотин
I![]() I.
R-СО-5’-
АМФ
-
синтетаза
+ Н2М-фермент R-CO-NH-фермент +
I.
R-СО-5’-
АМФ
-
синтетаза
+ Н2М-фермент R-CO-NH-фермент +
+5’-AMФ+cинтeтaзa.
Синтетический биотиниладенилат обладает способностью заменить смесь АТФ, MgCl и биотина при синтезе холофермента (Lynen, 1964). Позже было установлено, что образование других холоферментов протекает аналогичным образом. Все известные ферментативные реакции, для которых установлено участие биотина в качестве кофермента, являются процессами переноса углекислоты. По-видимому, в обратимом присоединении и отдаче СО; и состоит исключительная функция этого витамина в обмене веществ. Однако при биотиновой недостаточности нарушаются очень многие реакции обмена в интактном организме. Так, - биотин вовлечен в биосинтез белков, дезаминирование аспартата, серина и треонина у бактерий, обмен триптофана, жиров и углеводов, синтез пуринов, образование мочевины у животных и др. Природа участия биотина во многих из этих реакций остается неясной. Все перечисленные процессы имеют одну общую черту: при изучении in vitro они не тормозятся авидином. На основании этих данных считается, что биотин оказывает.непрямое действие на указанные превращения, которые катализируются ферментами, не содержащими этого витамина.
Ввиду чрезвычайной важности нeкоторых из этих реакций для жизне-деятельности организма необходимо рассмотреть их. Рядом авторов отмечено, что при недостаточности биотина в рационе крыс снижается включение в белок меченых аминокислот. Так, включение (С14-метионина, С14-лейцина и С14-лизина в тканевые белки снижается на 20—40% причем недостаточность биотина влияет на стадию образования амино-ацил-транспортной РНК. Препараты тРНК из печени нормальных крыс включают значительно больше меченых аминокислот, чем препараты печени авитаминозных животных (Dakshinainurti, Misty, 1964). Еще ранее было установлено, что у авитаминозных животных нарушается синтез амилазы в поджелудочной железе и сывороточного альбумина в печени, причем однократное введение 100 мкг биотина восстанавливает способность тканей к синтезу указанных белков. Добавление in vitro α-кетоглутарата и фумарата также восстанавливает образование амилазы и сывороточного альбумина (А. А. Познанская, 1957).
Эти данные показали, что биотин не принимает прямого участия в синтезе белка de novo, а его влияние на этот процесс, по-видимому, определяется вовлечением биотина в синтез субстратов трикарбонового цикла. Такое предположение нашло подтверждение в опытах на цыплятах: скармливание сукцината авитаминозным птицам восстанавливало до нормы включение аминокислот в тканевые белки и РНК. Так как образование С4-дикарбоновых кислот в организме животных протекает через фиксацию СО2, осуществляемую биотиновыми ферментами, то становятся ясными причины нарушения синтеза белка при биотиновой недостаточности. В организме авитаминозных цыплят значительно снижены скорость окисления глюкозы до СО2 и включение ее в гликоген печени. Имеются указания на снижение глюкокиназной активности при недостаточности биотина, хотя витамин не был обнаружен в препаратах кристаллического фермента. Возможно, что участие биотина в обмене. углеводов является непрямым. В результате нарушения утилизации глюкозы в организме животных при исключении биотина из корма нарушается превращение D-глюкозы в L-аскорбиновую кислоту.
При недостаточности биотина содержание липидов в печени животных снижается на 30°/о, что обусловлено снижением синтеза жирных кислот. Отсутствие биотина в корме цыплят приводит к повышению содержания триглицеридов, пальмитиновой и пальмитолеиновой кислот в печени, а также соотношения жирных кислот СО16, СО18 соотношение между насыщенными жирными кислотами при этом снижается. Включение введенных СО14-стеариновой и СО14-пальмитиновой кислот в фосфолипиды значительно повышается при недостаточности биотина, а включение их в триглицериды—снижается. При этом общее количество жирных кислот по сравнению с контролем понижено. В печени авитаминозных крыс снижено включение СО14-ацетата в липиды и наблюдается большее содержание ненасыщенных жирных кислот СО16:1 и СО18:2, тогда как уровень стеариновой кислоты снижен. Исключение биотина из корма крыс в течение 60 дней приводит к значительному снижению уровня цитидиловых, адениловых и гуаниловых нуклеотидов в печени. Содержание уридиловых нуклеотидов при этом почти не изменяется, а инозиловых — немного повышается. В то же время отсутствие биотина в рационе не влияет на содержание РНК и ДНК, а также на включение в них Р32, введенного внутрибрюшинно в виде Na2HP32O4.
Наконец, в гомогенатах печени авитаминозных крыс резко снижено образование цитруллина, которое полностью восстанавливается через 24 часа после введения животным биотина. Однако биотин не обнаружен в препаратах ферментов, участвующих в синтезе мочевины (карбамилфосфатсинтетаза, орнитинтранскарбамилаза и др.) и, по-видимому, в данном случае оказывает непрямое действие на эту реакцию.
6.1 Взаимодействие с другими витаминами. Установлена связь биотина с другими витаминами, в частности с фолиевой кислотой, витамином B12 - аскорбиновой кислотой, тиамином и пантотеновой кислотой. 0собенно тесные взаимоотношения существуют между биотином и фолиевой кислотой. Сначала было показано, что при недостатке биотина в печени крыс значительно снижено общее содержание веществ, обладающих активностью фолиевой кислоты. и что биотин стимулирует биосинтез этого витамина с флорой. Позднее было установлено, что у биотинавитаминозных крыс значительно снижено содержание коферментны.х форм фолиевой кислоты, а именно N5 и N10-формилтетрагидро-фолатов, тетрагидрофолата, N5_ и N10_ формилтетрагидроптероилглутаминовых кислот. Биотин стимулирует синтез метионина из серина и гомоцистеина и процессы метилирования вообще, способствуя накоплению коферментных форм фолиевой кислоты. Таким образом, при недостаточности биотина нарушена утилизация организмом фолиевой кислоты и превращение ее в активные коферментные формы. По-видимому, биотин принимает непосредственное участие в ферментативных процессах превращения фолиевой кислоты в ее коферментные производные (Marchetti e. а., 1966). Биотин благоприятно влияет на общее состояние организма и сохранение аскорбиновой кислоты в тканях цинготных морских свинок. В свою очередь аскорбиновая кислота замедляет, хотя и не предотвращает развитие авитаминоза биотина у крыс. При недостаточности биотина снижается содержание тиамина в печени, селезенке,. почках и мозге животных. У крыс, содержавшихся на рационе, лишенном биотина, содержание витамина B12 было выше, чем у контрольных животных, получавших биотин. Эти два витамина тесно связаны между собой в обмене пропионовой кислоты у микроорганизмов и животных. Существует тесная связь между биосинтезом биотина и пантотеновой кислоты у микроорганизмов и зеленых растений (В. В. Филиппов, 1962). Биотин облегчает симптомы пантотеновой недостаточности и, наоборот, пантотеновая кислота смягчает проявление авитаминоза биотина.
Похожие работы
... энергии затруднено. Гетероферментативное молочнокислое брожение — процесс более сложный, чем гомоферментативное: сбраживание углеводов приводит к образованию ряда соединений, накапливающихся в зависимости от условий процесса брожения. Одни бактерии образуют, помимо молочной кислоты, этиловый спирт и углекислоту, другие — уксусную кислоту; некоторые гетероферментативные молочнокислые бактерии могут ...
... два других отдела, отделенных мембраной, пирреллюлозому или рибоплазму, которая содержит рибосомы и связанные белки, и свободный от рибосом парафоплазму (Glockner, 2003). 3. Характеристика общих свойств микроорганизмов Микроорганизмы - это организмы, невидимые невооруженным глазом из-за их незначительных размеров. Этот критерий - единственный, который их объединяет. В остальном мир ...
... – переносят в кишечник новорожденного железо, витамины и другие важные соединения. Сывороточный белок α-лактоглобулин имеет специфическую функцию: он необходим для процесса синтеза лактозы. Казеин. Среднее количество его в молоке составляет 81% от общего содержания белков в молоке. Химически чистый казеин – белое аморфное вещество без запаха и вкуса – практически не растворяется в воде. ...
... России страдает от недостатка в питании витаминов и других функциональных веществ. Все большее распространение получают различные заболевания, снижается средняя продолжительность жизни. Химический состав плодов и овощей отличается большим разнообразием, он определяет цвет, вкус, запах, пищевую ценность продукта, сохраняемость и функциональные свойства. Энергетическая ценность большинства видов ...
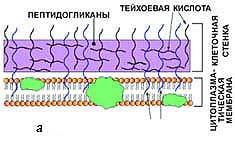
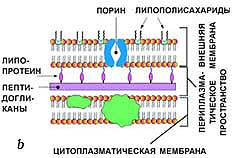

0 комментариев