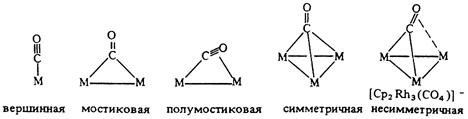
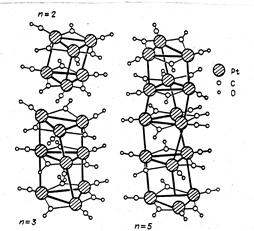
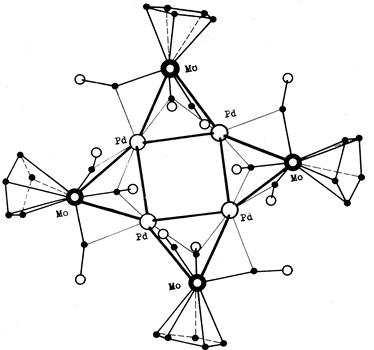
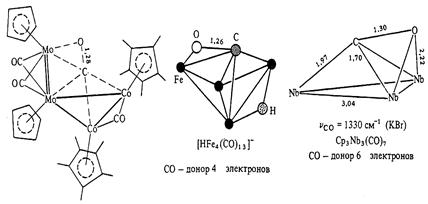
Навигация
Активация алкенов и алкинов
АКТИВАЦИЯ АЛКЕНОВ И АЛКИНОВ
1. π-Комплексы алкенов и алкинов
Превращения олефинов и ацетиленов относятся к важнейшим реакциям основного органического синтеза. Как правило, эти превращения включают активацию π-лигандов в π-комплексах переходных металлов. Фактически, в рамках тех понятий и терминов, которые мы обсуждаем, π-комплексы являются первичными комплексами.
π-Комплексы моноолефинов, сопряженных и несопряженных диолефинов и ацетиленов известны почти для всех переходных металлов. При этом встречаются моно-, би- и полиядерные соединения. Известны также соединения, содержащие 2, 3 и даже 4 молекулы олефина на атом металла, например, AcacRh(C2H4)2, Ni(C2H4)3 и Ir(C2H4)4Cl.
В ацетиленовых π-комплексах состава Mm(C2R2)n соотношение m/n меняется весьма широко. Например, известны комплексы состава Co4(CO)10(C2H2), Pt(C2R2)2, W(CO) (C2R2)3.
Координация всех π-лигандов сопровождается более или менее значительными изменениями их физических характеристик – понижается частота валентных колебаний кратных связей, увеличивается длина связей С-С, изменяются величины валентных углов.
Природа химической связи в π-комплексах переходных металлов имеет много общего. Рассмотрим основные положения на примере π-комплексов олефинов и ацетиленов.
Молекула этилена по величине потенциала ионизации не отличается от молекулы аммиака (IC2H4 = 10.5 эв). Донорные свойства ацетилена выражены несколько слабее (IC2H2 = 11.4 эв). В ацетилене, однако, нижние вакантные МО лежат ниже, чем у этилена, поэтому молекула ацетилена характеризуется более выраженными акцепторными свойствами.
Представления о природе связи в π-комплексах базируются на идеях Дьюара, Чатта и Данкансона, развитых более полувека назад. Модель Дьюара-Чатта-Данкансона, несмотря на ее упрощенность, может быть положена в основу концепции активации π-лигпндов в комплексах переходных металлов.
Рассмотрим, например, соль Цейзе KPtCl3(C2H4). Молекула этилена занимает координационное место в плоско-квадратном комплексе PtCl42-, вытесняя ион хлора:
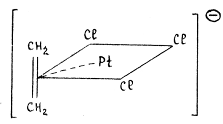
Гибридная орбиталь Pt(II) (например, dsp2-орбиталь) перекрывается с π-МО этилена, образуя трехцентровую двухэлектронную связь (донорно-акцепторная компонента связи). Гибридные заполненные 6dp-орбитали платины взаимодействуют с разрыхляющей π*-МО олефина, образуя вторую трехцентровую двухэлектронную связь (дативная компонента связи). В общем виде эти ситуация представлена на диаграмме:
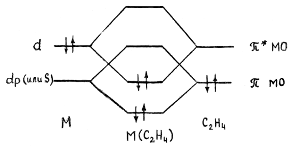
Обе трехцентровые связи вносят вклад в повышение прочности связи M-C2H4. Однако эти компоненты по разному влияют на свойства координированного π-лиганда.
В частности, образование дативной связи увеличивает заселенность разрыхляющей орбитали π-лиганда, что приводит к сильной дестабилизации координированной молекулы. Соотношение двух компонент связи металл-лиганд будет зависеть от свойств центрального атома, других лигандов и заместителей в молекуле π-лиганда. По степени изменения свойств π-лиганда все π-комплексы делятся на две группы.
I тип – π-комплексы, в которых изменение π-лиганда носит характер слабого возмущения.
II тип – π-комплексы, в которых сильно меняются порядок связи С-С и валентные углы.
Комплексы I типа обычно образуются металлами в высоких степенях окисления, связанных с электроотрицательными лигандами. Комплексы II типа образуют металлы в низких степенях окисления, связанные с мягкими основаниями. Так, например, соль Цейзе – K[PtCl3(C2H4)] – является примером комплекса I типа, а соединение (Ph3P)2Pt(C2H4) – примером комплекса II типа (см. данные таблицы).
| Комплекс | Тип | ΔνС=С, см-1 | LC=C, Ǻ | Положение С=С |
| K[PtCl3(C2H4)] (Ph3P)2Pt(C2H4) | I II | 118 > 200 | 1.37 1.43 | Перпендикулярно пл. PtCl3 В плоскости Pt(PPh3)2 |
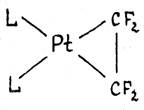
В комплексах c сильными электроотрицательными π-лигандами длины связей С-С приближаются к длине простой связи С-С в алканах. Например, в комплексе L2Pt(C2F4) длина связи С-С составляет 1.54 Ǻ, т.е. двойная связь по существу превращается в одинарную. Значения химсдвигов 19F и констант спин-спинового взаимодействия в спектре ЯМР комплекса также хорошо объясняются “циклопропановой” структурой.
Т.о., взаимодействие сильного донора L2Pt (0) с сильным акцептором C2F4 приводит к существенному переносу d-электронов на π-лиганд и образованию металлоцикла. Происходит окислительное присоединение π-лиганда к Pt(0) с образованием Pt(II) и аниона C2F42-.
Особенно отчетливо различие двух групп π-комплексов можно проследить в случае ацетиленовых лигандов (см. таблицу).
| Комплекс | Тип | ΔνС=С, см-1 | LC=C, Ǻ | Положение С=С |
| (Bu2C2PtCl2L* (Ph2C2)Pt(PPh3)2 | I II | 200 490 | 1.27 1.36 | Перпендикулярно пл. PtCl3 В плоскости Pt(PPh3)2 |
Похожие работы
... 1). В аналогичном комплексе иридия Ir(H)2(h2-H2)[P(C6H11)3]2 наблюдается быстрый обмен между координированным молекулярным водородом и гидридными лигандами. Однако в этих комплексах координирована молекула водорода и ее активация сводится лишь к удлинению связи H-H. В большинстве случаев взаимодействие водорода с комплексами переходных металлов приводит к разрыву связи в молекуле водорода. При ...
... реакции на альдегидную группу – окисляется оксидом серебра (1), присоединяет синильную кислоту (4): Химические свойства: 1. 2. 3. 4. 5. 6. 7. 8. Спиртовое брожение. Эта реакция характерна для гексоз. Она осуществляется с помощью биологических катализаторов – ферментов. При сбраживании гексозы превращаются в этиловый спирт. Для пентоз брожение ...
... Бензамид Амид N-бензоил- L-тирозина Мочевина Н3О+ Химотрипсин Н3О+ Уреаза 2,4∙10-6 14,9 7,4∙10-6 5,0∙106 52 25 62 21 II. Классификация катализаторов по степени дискретности и коллективности действия Взаимодействие катализатора с реагентами в газовой и жидкой фазе носит в основном дискретный характер (взаимодействие с одним реакционным ...
... кислот. Приведите примеры кислот. Зав. кафедрой -------------------------------------------------- Экзаменационный билет по предмету ХИМИЯ Билет № 19 Как классифицируются кислоты в зависимости от состава. Ответ иллюстрируйте примерами. Сформулируйте закон действующих масс и напишите его математическое выражение для реакции аА + вВ + сС Продукты. Охарактеризуйте ...
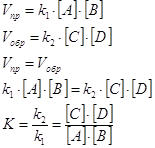
0 комментариев