Навигация
Фотоколориметрический метод
2. Фотоколориметрический метод
Помещают 5 мл раствора в мерную колбу вместимостью 25 мл и доводят до метки водой (раствор А).
К 5 мл раствора А прибавляют 1 мл 1% раствора железа(III) хлорида, 4 мл воды и перемешивают. Через 50 мин. измеряют оптическую плотность (А1) окрашенного раствора при длине волны около 370 нм в кювете с толщиной слоя 3 мм. Окраска устойчива 15–20 мин.
Раствор сравнения – смесь 1 мл 1% раствора железа (III) хлорида и 9 мл воды (готовят одновременно с окрашенным анализируемым раствором).
Параллельно в тех же условиях проводят реакцию с 5 мл раствора СО натрия ацетата (0,0026 г) и измеряют оптическую плотность (А2).
2.3 Вывод
Из всех возможных методик количественного анализа данной лекарственной формы приведенного состава были выбраны:
– фотоколориметрия (для Натрия ацетата);
– аргентометрия по Мору (для Натрия хлорида).
Из всех возможных методик качественного анализа данной лекарственной формы приведенного состава были выбраны:
– образование осадка хлорида серебра (для хлорид-иона);
– окрашивание пламени горелки (для иона натрия);
– образование этилацетата (для ацетат-иона).
3. Экспериментальная часть
3.1 Специфичность
3.1.1 Установление специфичности в тестах «Испытание на подлинность»
Следует убедиться в отсутствии положительного эффекта реакции на сопутствующие вещества: другие ингредиенты лекарственного средства и вспомогательные вещества.
Практическое установление специфичности
Были приготовлены три модельные смеси состава:
Первая:
1. Натрия хлорида 0,5 г
2. Натрия ацетата 0,2 г
3. Воды очищенной до 100 мл
Вторая:
1. Натрия ацетата 0,2 г
2. Воды очищенной до 100 мл
Третья:
1. Натрия хлорида 0,5 г
2. Воды очищенной до 100 мл
Для проведения валидационной оценки, с тремя модельными смесями были проведены следующие реакции:
1. Хлорид-ион
К 0,5 мл модельного раствора прибавили по 0,5 мл HNO3 разб. и раствор AgNO3 0,1М. Образовался белый творожистый осадок, растворившийся в растворе аммиака.
NaCl + AgNO3 → NaNO3 + AgCl↓
2. Ион натрия
На шпатель была помещена капля раствора и внесена в пламя горелки. Наблюдалось окрашивание пламени в желтый цвет.
3. Ацетат-ион
Упаривали 10 мл раствора на водяной бане до 1 мл, прибавляли 0,5 мл кислоты серной конц., 1 мл спирта этилового 96% и нагревали. Ощущался запах этилацетата.
CH3COONa + CH3CH2OH → CH3COOC2H5↑ + NaOH
3.1.2 Установление специфичности в тестах «Количественное определение»
Следует убедиться, что растворители и сопутствующие компоненты не вступают в реакцию с титрантом, а также необходимо удостовериться в специфичности индикатора.
1. Для проведения специфичности Хлорида натрия использовали титриметрический метод анализа. Для чего брали три модельные смеси. Титрование проводилось по следующей методике: к 5 мл навески прибавляли 2 мл воды, 2 капли K2CrO4 и титровали 0,1М раствором AgNO3 до появления оранжево-желтой окраски.
NaCl + AgNO3 → AgCl↓ + NaNO3
AgNO3 + K2CrO4 → Ag2CrO4↓ + 2KNO3
2. Для проведения специфичности Ацетата натрия использовали фотоколориметрический метод анализа. Для этого использовали 3 модельные смеси. Определение проводилось следующим образом: помещали 5 мл раствора в мерную колбу вместимостью 25 мл и доводили до метки водой (раствор А). К 5 мл раствора А прибавляли 1 мл 1% раствора FeCl3, 4 мл воды и перемешивали. Через 50 мин измерили оптическую плотность окрашенного раствора при длине волны около 490 нм в кювете с толщиной слоя 3 мм. Параллельно готовили раствор сравнения – смесь 1 мл 1% раствора FeCl3 и 9 мл воды. Параллельно в тех же условиях проводили реакцию с 5 мл раствора СО натрия ацетата (0,0026 г) и измеряли оптическую плотность.
Результаты испытания на специфичность представлены в таблице 1 и 2
Табл 1. Подлинность
| Модельные смеси | |||
| Компоненты | I | II | III |
| 1. Натрия хлорид | + | + | - |
| белый осадок | белый осадок | ||
| 2. Натрия ацетат | + | - | + |
| запах | запах | ||
Табл 2. Количественное определение
| Модельные смеси | |||
| Компоненты | I | II | III |
| 1. Натрия хлорид | 5,0 мл | 4,8 мл | - |
| 2. Натрия ацетат | 0,035 | - | 0,035 |
3.1.3 Вывод
По результатам экспериментов можно сделать заключение о специфичности выбранных методик определения подлинности и количественного определения.
3.2 Прецизионность (повторяемость)
Для установления повторяемости было проведено 6 параллельных определений содержания компонента в модельной смеси.
3.2.1 Опеделение прецизионности в тесте «Количественное определение» титриметическим методом
Для этого из модельной смеси 3 было отобрано 6 аликвот, которые оттитровали раствором нитрата серебра 0,1М. Результаты измерений представлены в таблице 3.
Табл 3. Результаты определения прецизионности титриметрическим методом
| Vтит, мл | Найдено, Xi | Xi- | (Xi- | метрологические характеристики |
| 4,1 | 4,79 | -0,04167 | 0,001736 | SD=0,065727 |
| 4,1 | 4,79 | -0,04167 | 0,001736 | |
| 4,1 | 4,79 | -0,04167 | 0,001736 | |
| 4,2 | 4,91 | 0,078333 | 0,006136 | RSD=2,7% |
| 4,2 | 4,91 | 0,078333 | 0,006136 | |
| 4,2 | 4,91 | 0,078333 | 0,006136 | |
|
| ∑=0,0216 |
SD=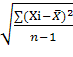 RSD=
RSD=![]() Xi=
Xi=![]()
T=M×Mм×![]()
Mм=58,44 ![]()
М=0,1М
K=1,00
P=1000 мл
a=5 мл
0 комментариев