Навигация
Квантовые числа, интервалы возможных значений
8.20.1. Квантовые числа, интервалы возможных значений.
8.20.2. Водородоподобные атомные орбитали.
Угловые компоненты АО и распределение вероятностей.
Полярные функции азимута Qlm(J) и функций широты F|m|(j)
| Alm(q) | ql,m(J) | A(j) | F|m|(j) |
| (1/2) ½ | 1 | (1/2p) ½ | 1 |
| (3/2) ½ | cosJ | (1/2p) ½ | 1 |
| (3/4) ½ | sinJ | (1/2p) ½ | exp(±ij) |
| (5/8) ½ | 3×cos2J-1 | (1/2p) ½ | 1 |
| (15/16) ½ | sin2J | (1/2p) ½ | exp(±ij) |
| (15/16) ½ | sin2J | (1/2p) ½ | exp(±i2j) |
|
| 5×cos2J -3×cosJ | (1/2p) ½ | 1 |
|
| (5×cos2J -1)×sinJ | (1/2p) ½ | exp(±ij) |
|
| sin2J×cosJ | (1/2p) ½ | exp(±i2j) |
|
| sin3J | (1/2p) ½ | exp(±i3j) |
Полярные диаграммы функций азимута Qlm(J) и функций широты F|m|(j).
Радиальные компоненты АО атома Н и их графики. Радиальное распределение плотности вероятности и квантово-химический смысл боровского радиуса.
| Anl |
|
|
| AZ |
| 2 | 1 | exp(-) |
| (Z/a0)3/2 |
| 1/23/2 | 2- |
exp(-) |
| |
| (½)×1/61/2 | | |||
| (2/81)×1/31/2 | 27-18+22 |
exp(-) |
| |
| (4/81)×1/31/2 | 6- 2 | |||
| (4/81)×1/31/2 | 2 | |||
| (1/192)×(¼) | 192-14423 |
exp(-4) |
| |
| (1/80)×(1/16)×(5/3)1/2 | 8023 | |||
| (1/12)×(1/64)×1/51/2 | 1223 | |||
| (1/768)×1/351/2 | 3 |
= Z(r/a0)
8.20.1. Квантовые числа, интервалы возможных значений.
8.20.3. Пространственные размеры атома водорода.
8.20.4. Наиболее вероятное удаление электрона от ядра.
(Радиус наибольшей плотности вероятности)
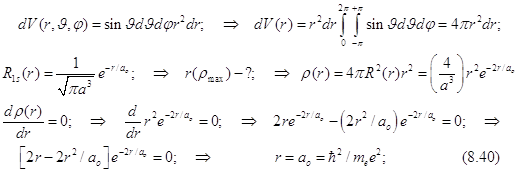
Радиус максимальной плотности вероятности называется боровским радиусом и совпадает с радиусом первой орбиты в теории атома водорода по Бору.
8.20.5.Среднее расстояние электрона от ядра.
Поскольку АО представляет собою нормированную одноэлектронную волновую функцию, то знаменатель в формуле для среднего значения любой физической величины, в том числе и расстояния электрона от ядра можно не выписывать, он равен единице, и отсюда следует:
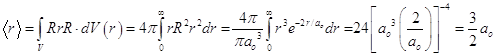 . (8.41)
. (8.41)
Среднее расстояние электрона от ядра в полтора раза больше наиболее вероятного - боровского радиуса.
Примечание. Использован вспомогательный интеграл: 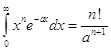
(См. теорию Эйлера Гамма - функции 1-го рода).
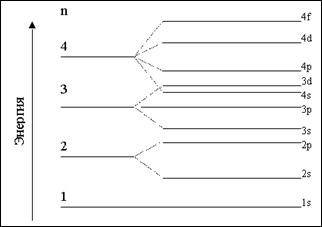
Энергетическая диаграмма уровней АО атома Н и Z-1–зарядного водородоподобного иона приводится ниже, где она качественные сравнивается со схемой уровней многоэлектронного атома.
Похожие работы
... 9.2. Водородоподобные орбитали. Многоэлектронный гамильтониан атомной оболочки. Межэлектронное отталкивание как экранирование ядра. Одноэлектронное приближение. Орбитали многоэлектронного атома. 2. Элементы теории многоэлектронных атомов 2.1. Многоэлектронный атом. Содержание. Электронный гамильтониан многоэлектронного атома. Отталкивание электронов, потенциальная энергия отталкивания и ...
... массой, большей урана. В наши дни такие «трансурановые» элементы были получены искусственно. Вполне можно утверждать, что предела таблицы не существует и получение или нахождение других трансурановых элементов – это дело будущего. Таково, в общих чертах, учение об атомах химических элементов, созданное Дальтоном и определившее все дальнейшее развитие химии в XIX столетии. , с помощью ...
... орбиты; 3. Магнитным квантовым числом, характеризующим положение облаков в пространстве; 4. И спиновым квантовым числом, характеризующим веретенообразное движение электрона вокруг своей оси. [ 1, 4 ] Глава II. Строение атома Химики XIXв. Не в состоянии были ответить на вопрос, в чем суть различий между атомами разных элементов, например меди и йода. Лишь в период 1897-1911гг. ...
... этому времени: открытие радиоактивности, экспериментальное доказательство ядерной модели ядра, измерение отношения e / m для электрона, α-частицы и для так называемой H-частицы – ядра атома водорода, открытие искусственной радиоактивности и ядерных реакций, измерение зарядов атомных ядер и т. д. В настоящее время твердо установлено, что атомные ядра различных элементов состоят из двух частиц ...
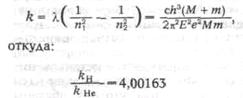


0 комментариев