Навигация
Визначення Купруму титриметричними методами
3.2 Визначення Купруму титриметричними методами
Найбільше розповсюдження з титриметричних методів визначення Купруму отримали комплекснометричний і йодометричний. Методи осадження, що базуються на утворенні важкорозчинних осадів, в основному з сірковмісними органічними сполуками, закінчують, як правило, елекрохімічно.
Алкаліметричне визначення Купруму з використанням крезолфталеїну для встановлення кінця титрування відрізняється швидкістю, але невисокою точністю.
Пряме титрування солей Купруму можливе солями металів в нижчих степенях окислення.
Потенціометричне титрування Сu (ІІ) розчином Fe (II) з Pt-електродом проводять в 14 М H3PO4.
Броматометричний метод пропонує виділення міді дитизоном, ο-оксихіноліном або резацетофеноном, розчинення осаду та титрування бромат-бромідним розчином в присутності метилового оранжевого. Розроблений варіант броматометричного визначення міді з попереднім виділенням її дифенилтіовіолуровою кислотою. Похибка визначення 20-30 мг міді складає 0,03-0,08%.
Виділення міді (ІІ) в осад проводять як неорганічними, так і органічними (в основному сірковмісними) осаджувачами. [4]
Титриметричний метод аналізу - метод кількісного аналізу, який ґрунтується на вимірюванні кількості реагента, необхідного для завершення реакції з певною кількістю визначуваної речовини. Метод полягає в тому, що до розчину визначуваної речовини поступово додають розчин реактива відомої концентрації. Додавання реактиву відбувається до тих пір, поки його кількість не стане еквівалентна кількості визначуваної речовини.
Титриметричні методи аналізу ґрунтуються на використанні самих різноманітних реакцій: нейтралізації, окислення - відновлення, осадження, комплексоутворення.
За способом виконання розрізняють пряме титрування, зворотне титрування та титрування замісника.
Для проведення хімічного аналізу титриметричним методом крім звичайного хімічного посуду широко використовують мірний посуд, який служить для точного вимірювання об’ємів розчинів. До нього відносять: мірні колби, піпетки, бюретки.
Чим відповідальніше проводять дані вимірювання, тим точніші результати аналізу. [5]
4.3 Визначення Купруму фотометричними методами
Мідь утворює забарвлені сполуки з великим числом органічних сполук різних класів.
Найбільш широко застосованим і доступним реагентом є діетилдитіокарбамат натрію. В присутності комплексоутворювачів реагент достатньо селективний і чутливий. Набагато більшою вибірковістю володіють диетилдитіокарбамати кадмію, свинцю і цинку. [4]
Екстракційно-фотометричне визначення з діетилдитіокарбаматом свинцю.
Іони Купруму реагують з діетилдитіокарбамінатом свинцю у хлороформі з утворенням нерозчинної у воді комплексної сполуки:
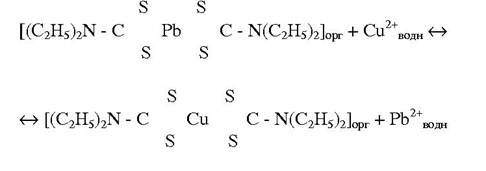
При 430 нм зберігається лінійна залежність між вмістом Купруму і оптичною густиною неводного розчину в інтервалі концентрацій 0,5 - 10 мкг. Чутливість методу становить 2 мкг Cu/л.
Визначенню Купруму заважає понад 30 мкг/л вісмуту, а також іони срібла та ртуті. Іони вісмуту також утворюють розчинний у хлороформі комплекс жовтого кольору, а срібло та ртуть - безбарвні комплекси. Комплексні ціаніди повинні бути зруйновані випарюванням проби з 0,5 мл розбавленої (1:1) сірчаної кислоти і 5 мл концентрованої азотної кислоти. Проби з високим вмістом органічних сполук мінералізують за допомогою персульфату. [7]
Специфічним реагентом на мідь є дисульфід меркаптохіноліну. Найбільш чутливим (але не селективним) є дитизон. На відміну від інших реагентів його можна застосовувати в кислих розчинах. Похідні 1,10-фенантроліну менш чутливі, ніж ДДТК-Na. Визначенню міді з використанням цих реагентів заважають аніони-комплексоутворювачі. 2,2΄-Дихіноліл і його похідні практично можуть бути застосовані для аналізу будь-яких об’єктів. [4]
Екстракційно-фотометричне визначення з дитизоном.
Іони Купруму екстрагують з води розчином дитизону (2-фенілгідразид тіомурашиної кислоти, синонім - дифенілтіокарбазон ) у чотирихлористому вуглеці. При цьому утворюється забарвлений у червоний колір комплекс дитизонату міді, інтенсивність забарвлення якого пропорційна концентрації міді:
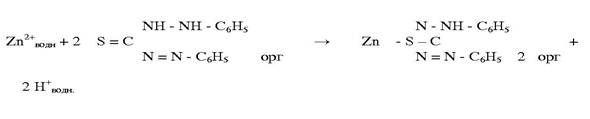
Іони міді кількісно екстрагуються дитизоном в інтервалі рН 4 - 7. [7]
Для аналізу об’єктів, що містять великі кількості міді, часто використовують різні комплексони та аміни.
Все більше значення набувають каталітичні методи визначення міді, що використовують її здатність каталізувати деякі реакції та дозволяють визначати до 10-6% Cu.
Високою чутливістю і достатньою селективністю володіє фотометричний метод з використанням дикупралю, який дозволяє визначити 0,05 - 0,1 мг/л міді в мутних і кольорових водах. Методи з використанням дитизону і його похідних володіють високою чутливістю, але маловибіркові. Тому дитизон використовують, як правило, для концентрування міді з природних вод. Визначення закінчують використанням інших органічних реагаентів або спектральним методом.
Фотометричнй метод ґрунтується на вимірюванні поглинання світла, що падає на речовину (зразок). Його частіше усього вимірюють шляхом зрівняння інтенсивності світла зовнішнього джерела, що падає на зразок та інтенсивності світла, що пройшла через зразок. При вимірюванні інтенсивності світла може відбуватися не тільки світлопоглинання, а також відбивання та розсіювання. Щоб цього уникнути розчин, що фотометрують повинен бути прозорим.
Розрізняють два важливих закони світлопоглинання: закон Бугера – Ламберта – Бера та закон адитивності.
Закон Бугера – Ламберта – Бера виражає залежність між зменшенням інтенсивності, що пройшла через шар світлопоглинаючої речовини, концентрацією речовини та товщиною шару. І має таку загальну формулу (1):
А = Е l С, (1)
де А - оптична густина;
С - концентрація частинок, що поглинають;
l - товщина шару розчину, який містить частинки, що поглинають.
Згідно закону адитивності, оптична густина суміші речовин, які підпорядковуються закону Бугера - Ламберта - Бера та не взаємодіють між собою, дорівнює сумі оптичних густин, які відповідають поглинанню кожної речовини, основою є формула (2):
А = Е1 l c1 + Е2 l c2 + ... (2)
В фотометрії для реєстрації спектроскопічних сигналів використовують такі основні вузли: джерело світла, монохроматизатор світла, кювети, пристрій для визначення інтенсивності світла.
Для вимірювання в видимій частині спектру використовують кювети із скла. А для вимірювання в ультрафіолетовій частині спектру використовують кювети із кварцу. [8]
Фотометричний метод відноситься до середньо чутливих методів; нижня межа визначуваної концентрації min = 10-7М; верхня межа визначуваної концентрації max = 10-2М; відносна похибка 3 - 5%; селективність невисока.
Похожие работы
... Україні - 0,5 мг), що пояснюється його блокувальною дією щодо шкідливих і канцерогенних важких металів: кадмію, меркурію, плюмбуму. 2.1 Сполуки меркурію (ртуті) Вони належать до найнебезпечніших забруднювачів біосфери. Великі кількості цих сполук містяться у стоках хімічних заводів (підприємств, які виробляють натрію гідроксид, ацетальдегід), паперових і целюлозних виробництв, у продуктах ...
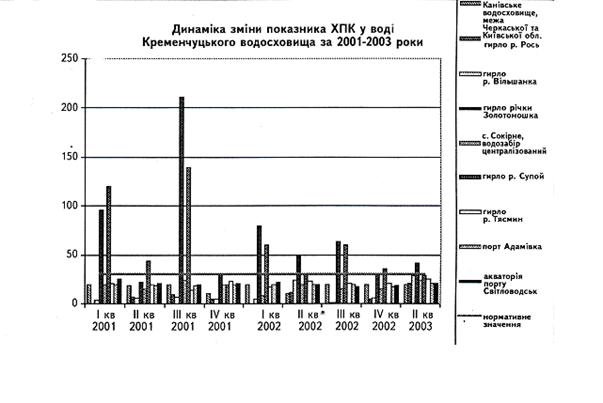
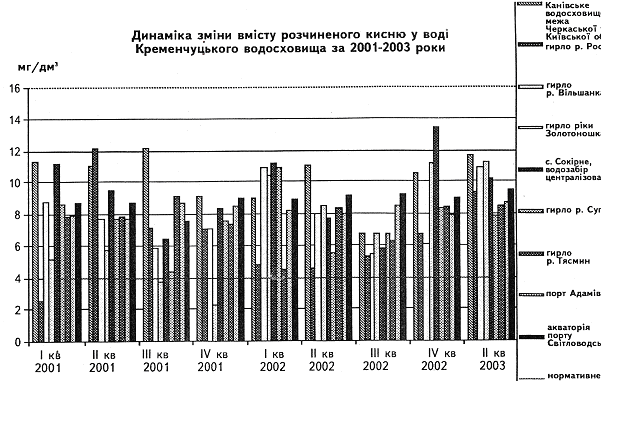
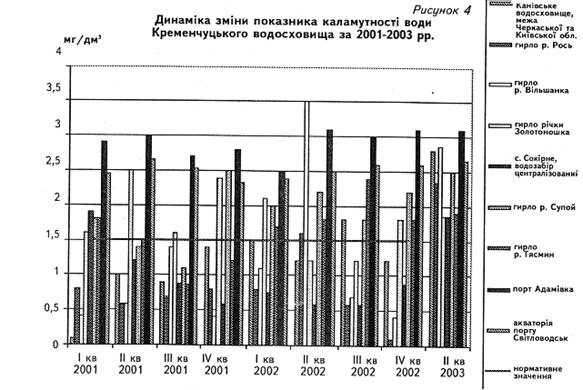
... у кістяку наземних видів тварин. Нині людство майже не вживає природну питну воду і перейшло на техногенну — її одержують на водопровідних станціях шляхом фізико-хімічної обробки [1]. 2 СТАН ГІДРОБІОЦЕНОЗУ КРЕМЕНЧУЦЬКОГО ВОДОСХОВИЩА 2.1 Гігієнічний моніторинг Кременчуцього водосховища 2.1.1 Створення моніторингу Кременчуцького водосховища в межах Черкаського регіону ...
... сполуки”, а також зорієнтовані на їх загальний розвиток. Об’єкт дослідження: процес вивчення теми “Залізо та його сполуки” у класах з поглибленим вивченням хімії,мтворчо та інтелектуально обдарованими учнями. Предмет дослідження: навчання особливості організації та змісту урочної навчальної діяльності учнів. Дане педагогічне дослідження має переваги над існуючою традиційною технологією, яка ...
... класах проходить по-різному. Необхідна її адаптація до конкретних умов проведення [20]. РОЗДІЛ 3. МЕТОДИЧНІ ЗАБЕЗПЕЧЕННЯ ПРОВЕДЕННЯ УРОКІВ З ТЕМИ „МЕТАЛИ” 3.1 Тематичне планування теми „Метали” Тема „Метали” вивчається в 9 класі в середині другого семестру навчального року, на вивчення теми передбачено програмою 22 години. Тематичне планування представлено в табл. 3.1. Таблиця ...
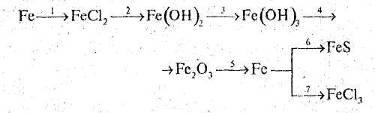

0 комментариев