Навигация
Екстракційно-фотометричне визначення купруму в природній воді
4. Екстракційно-фотометричне визначення купруму в природній воді
Визначення Купруму базується на утворенні комплексу з діетилдитіокарбаматом жовтого кольору, подальшій його екстракції і фотометруванні органічного шару. Оскільки визначенню заважають інші катіони металів, аналіз проводять при певному рН у присутності цитратної кислоти, яка зв'язує Fe3+, Zn2+, Mn2+ в безбарвні комплекси, що залишаються у водній фазі.
Обладнання: фотоелектроколориметр, кювети з товщиною світлопоглинаючого шару 1 см, аналітичні та електронні терези, ділильна лійка, пробірки з притертою пробкою, піпетки, колби, циліндри, склянка з темного скла, мірний циліндр.
4.1 Приготування розчинів
Розчин діетилдитіокарбамату плюмбуму в CCl4
На аналітичних терезах зважують 0,0486 г Pb(NO3)2 , розчиняють в 10 мл дистильованої води (відібравши певний об'єм мірною піпеткою). Зважують 0,0664 г ДЕТК Na. В ділильну лійку вносять 100 мл CCl4 (вимірявши об'єм мірним циліндром), 0,0664 г ДЕТК Na та 0,0486 г Pb(NO3)2 (попередньо розчиненого в 10 мл води). Отриману суміш в ділильній лійці струшують протягом 5 хвилин. Після чого закріплюють лійку на штатив та дають відстоятися розчину дві хвилини. Нижній органічний шар із розчиненим у ньому ДЕТК Рb фільтрують в склянку з темного скла. Розчин повинен зберігатися в холодильнику.
Стандартний розчин Купруму
На аналітичних терезах зважують 0,98 г CuSO4·5H2O. Зважену масу переносять в мірну колбу на 25 мл, при цьому доливши до половини колби дистильованої води. Потім додають 1,3 мл концентрованої H2SO4 (обережно, дотримуючись техніки безпеки, за допомогою мірної піпетки).
5-% розчин цитрату амонію
На електронних терезах зважують 5 г лимонокислого амонію. Беруть колбу на 100 мл. Переносять туди 5 г солі та доводять дистильованою водою до мітки
За даними методики (1 мл містить 100 мкг Cu2+) концентрація вихідного стандартного розчину С = 10 мг/мл.
Проводять розбавлення стандартного розчину:
1. 0,5 мл вихідного розчину розбавляють водою до 50мл, утворився розчин 1 ;
2. 5 мл розчину 1 розбавляють водою до 50 мл, робочий вихідний розчин.
Тоді, відповідно концентрація розбавленого розчину: С = 10мкг/мл.
4.2 Проведення аналізу
У п'ять мірних колб на 25 мл відбирають піпеткою визначені об'єми стандартного розчину: 1 мл, 5 мл, 10 мл, 15 мл, 20 мл відповідно.
У ділильну лійку вносять: 25 мл природної води (з криниці масиву "Вишенька"), приливають 5 мл розчину цитрату амонію, 15 мл ДЕТК плюмбуму в CCl4 та відповідні об'єми стандартного розчину. Отриману суміш енергійно струшують 2 хвилини. Дають відстоятися. Після розділення фаз нижній органічний шар, забарвлений у жовто-коричневий колір, обережно зливають в суху пробірку з притертою пробкою.
Фотометрування проводять у кюветах з товщиною світлопоглинаючого шару 1 см при λ=436 нм (синій світлофільтр) відносно чистого CCl4 . Виконують 4 паралельних вимірювання природної води.
4.3 Обробка результатів
Табл.1 Дані для побудови градуювального графіка
| № розчину | 1 | 2 | 3 | 4 | 5 | Досл. р-н 1 | Досл. р-н 2 | Досл. р-н 3 | Досл. р-н 4 |
| А | 0,05 | 0,09 | 0,15 | 0,2 | 0,25 | 0,056 | 0,06 | 0,054 | 0,061 |
| m, мкг | 1 | 5 | 10 | 15 | 20 | 2 | 2,2 | 1,9 | 2,3 |
Будуємо пряму за рівнянням:
Y=A + BX,
де Y - оптична густина, X - вміст компоненту, коефіцієнти А і В дорівнюють:
коефіцієнт А=0,03964, коефіцієнт В=0,01062, коефіцієнт кореляції =0,9994
А1 = 0,03964+0,01062·5=0,09274
А2=0,03964+0,01062·15=0,19894
За графіком знаходимо маси:
m1=2 мкг
m2=2,2 мкг
m3=1,9 мкг
m4=2,3 мкг
1. Середнє значення:
![]() мкг;
мкг;
2. Дисперсія:
V=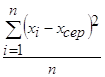 =
=![]()
3. Середнє квадратичне відхилення:
S = 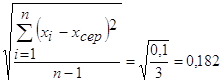
4. Відхилення від середнього арифметичного:
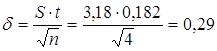 мкг
мкг
Табл.2 Експериментальні дані оброблені методом математичної статистики
| xi, мкг | n | xсер, мкг | V | S |
| xсер | |
| 2 | 4 | 2,1 | 0,025 | 0,182 | 0,29 | 2,1 |
|
| 2,2 |
| ||||||
| 1,9 |
| ||||||
| 2,3 |
| ||||||
Таким чином, вміст Купруму в природній воді = 2,1![]() 0,3 мкг. Тобто, це кількість компоненту в 25 мл.
0,3 мкг. Тобто, це кількість компоненту в 25 мл.
ГДК Купруму в природній воді = 0,1 мг/л.
Для даного визначення: 2,1 мкг Купруму міститься в 25 мл природної води, тоді в 1 мл міститься 0,084 мкг Купруму. Тобто, вміст Купруму дорівнює 0,084 мг/л, що є меншим за встановлену ГДК.
Висновок
Хоча купрум не є токсичним елементом, наявність його в природних водах та грунтах регламентується на рівні ГДК (гранично допустимих концентрацій). Тому визначення його в об’єктах навколишнього середовища є необхідним.
Купрум в природній воді можна визначити гравіметричним, титриметричним, фотометричним методами, методами атомно-емісійної та атомно-адсорбційної спектроскопії та деякими іншими фізико-хімічними методами.
Вдалим вибором для визначення сполук Купруму є фотометричний метод. Він має ряд переваг: досить дешеве та просте в використанні обладнання, простота обладнання та ін.
Фотометричний метод широко застосовується в аналізі природних, стічних вод, грунтів, атмосферного повітря, донних мулів, відходів виробництва.
Екстракційно-фотометричне визначення Купруму показало, що вміст елементу в природній воді дорівнює 0,084 мг/л. Отриманий результат не перевищує гранично допустимої концентрації.
Список використаної літератури
1 Крисаченко В.С., Хилько М.І. Екологія. Культура. Політика: Концептуальні засади сучасного розвитку. - К.: "Знання", 2001. - 598 с.
2 Б.И. Набиванец, П.Н. Линник, Л.В. Калабина. Кинетические методы анализа природных вод.- Киев: "Наукова думка", 1981.- 140с.
3 Основи екології: теорія та практикум: Навч.посіб./ Г.О. Білявський, Л.І. Бутченко, В.М. Навроцький. - К.: Лібра, 2002 - 352с.
4 Медь/ В.Н. Подчайнова, Л.Н. Симонова. - М.: Наука, 1990. - 279 с.
5 Крешков А. П. Основы аналитической химии. Теоретические основы. Количественный анализ, книга вторая, изд. 4-е, перераб. М., "Химия", 1976. - 480с.
6 В.П. Васильев. Аналитическая химия. В 2 ч. - М.: Высш. шк., 1989 - 320 с.
7 Б.Й. Набиванець, В.В. Сухан, Л.В. Калабіна. Аналітична хімія природного середовища. - К.: Либідь, 1996.- 304с.
8 Основы аналитической химии. В 2 кн. Кн. 2. Методы химического анализа: Учеб. Для вузов / Ю. А. Золотов, Е. Н. Дорохова, В. И. Фадеева и др. Под ред. Ю. А. Золотова - 2-е изд., перераб. и доп. - М.: Высшая школа.; 2002. - 494 с.
Похожие работы
... Україні - 0,5 мг), що пояснюється його блокувальною дією щодо шкідливих і канцерогенних важких металів: кадмію, меркурію, плюмбуму. 2.1 Сполуки меркурію (ртуті) Вони належать до найнебезпечніших забруднювачів біосфери. Великі кількості цих сполук містяться у стоках хімічних заводів (підприємств, які виробляють натрію гідроксид, ацетальдегід), паперових і целюлозних виробництв, у продуктах ...
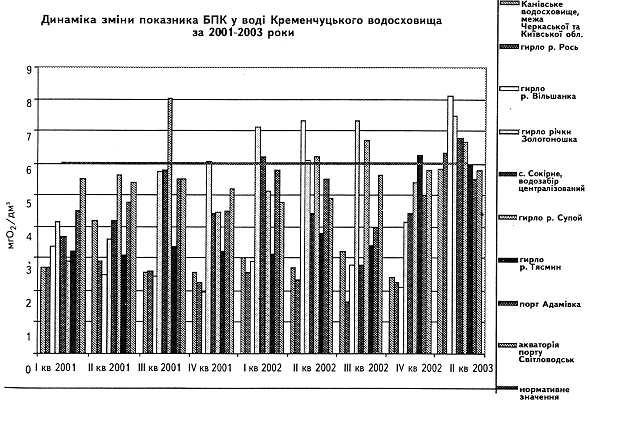
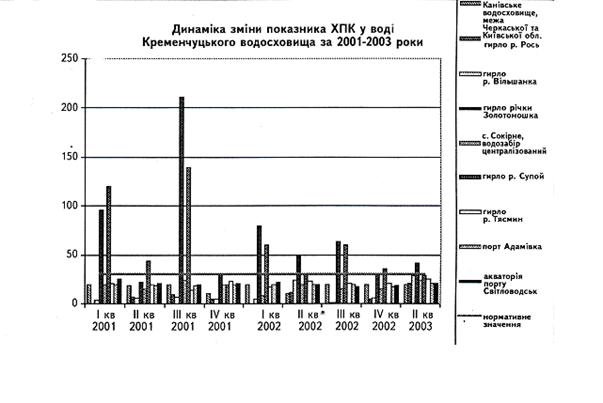
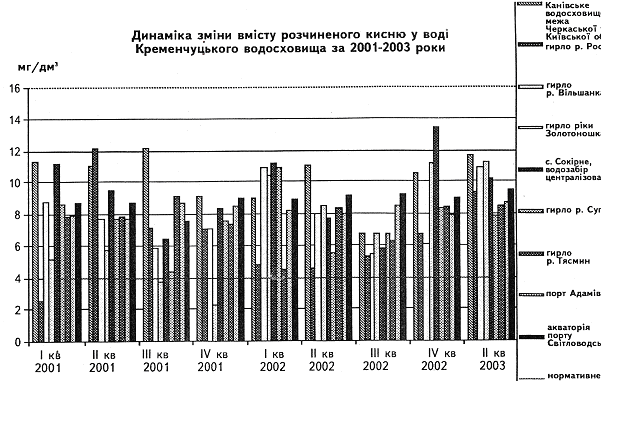
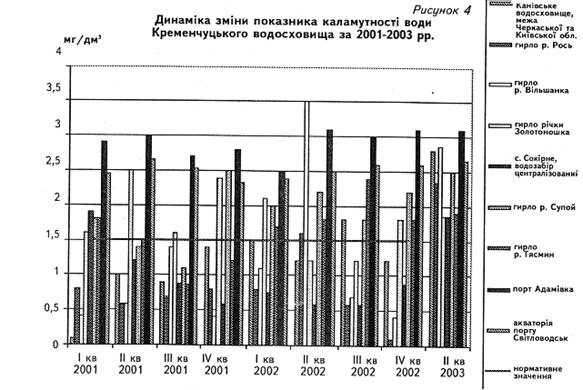
... у кістяку наземних видів тварин. Нині людство майже не вживає природну питну воду і перейшло на техногенну — її одержують на водопровідних станціях шляхом фізико-хімічної обробки [1]. 2 СТАН ГІДРОБІОЦЕНОЗУ КРЕМЕНЧУЦЬКОГО ВОДОСХОВИЩА 2.1 Гігієнічний моніторинг Кременчуцього водосховища 2.1.1 Створення моніторингу Кременчуцького водосховища в межах Черкаського регіону ...
... сполуки”, а також зорієнтовані на їх загальний розвиток. Об’єкт дослідження: процес вивчення теми “Залізо та його сполуки” у класах з поглибленим вивченням хімії,мтворчо та інтелектуально обдарованими учнями. Предмет дослідження: навчання особливості організації та змісту урочної навчальної діяльності учнів. Дане педагогічне дослідження має переваги над існуючою традиційною технологією, яка ...
... класах проходить по-різному. Необхідна її адаптація до конкретних умов проведення [20]. РОЗДІЛ 3. МЕТОДИЧНІ ЗАБЕЗПЕЧЕННЯ ПРОВЕДЕННЯ УРОКІВ З ТЕМИ „МЕТАЛИ” 3.1 Тематичне планування теми „Метали” Тема „Метали” вивчається в 9 класі в середині другого семестру навчального року, на вивчення теми передбачено програмою 22 години. Тематичне планування представлено в табл. 3.1. Таблиця ...
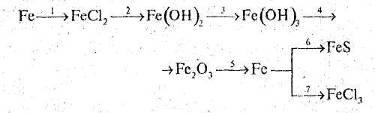

0 комментариев