Навигация
Методы исследования
2.2 Методы исследования
2.2.1 Клинико-лабораторные методы исследования
Клинико – эпидемиологический анализ больных туберкулезом включал: возраст начала заболевания, социальную категорию, вредные привычки (курение, злоупотребление алкоголем, употребление наркотиков), сопутствующую патологию, наличие контакта с туберкулезным больным, а также данные о туберкулезе у родственников больного. Анализу подвергались выраженность клинических проявлений (жалобы, объективный статус больного), результаты лабораторных и инструментальных методов исследования (микроскопия и посев мокроты на МБТ, чувствительность к противотуберкулезным препаратам, рентгенологическое исследование легких, общий анализ крови) на момент начала заболевания.
Для решения задачи по оптимизации и стандартизации сбора информации о больном ТБ была разработана специальная карта "Унифицированный носитель информации", содержащая блоки, охватывающие сведения о жалобах больного, эпидемиологическом анамнезе, анамнезе заболевания, объективном статусе, результатах лабораторного и инструментального обследования. В дальнейшем на основании сведений из этих карт была создана электронная база данных в формате Microsoft Excel.
2.2.2 Молекулярно – генетические методы анализа полиморфизма генов
Всего было изучено 9 полиморфных вариантов пяти генов – кандидатов подверженности туберкулезу. Исследовали 4 полиморфных варианта гена NRAMP1: 469+14G/C (INT4) – трансверсия гуанина на цитозин в 4 интроне, С274Т – консервативная замена в 3 экзоне, 1465-85 G/A – транзиция в 13 интроне и D543N – неконсервативная замена цитозина на аденин в 15 экзоне; два полиморфизма VDR гена: B/b, F/f; полиморфный вариант IL1B гена в 5 экзоне +3953А1/А2; VNTR полиморфизм гена IL1RN, расположенный во 2 интроне. Также выборки генотипировали по полиморфизму гена IL12В, обусловленному трансверсией аденина на цитозин в 3`-UTR области (табл. 4).
Для генотипирования индивидов по указанным полиморфизмам использовали образцы тотальной ДНК, выделенной из цельной венозной крови по стандартной неэнзиматической методике [Маниатис Т. и др., 1984; Lahiri D. et al., 1992]. Выделенную ДНК замораживали и хранили при температуре -20° С до проведения эксперимента. Генотипирование осуществляли с помощью полимеразной цепной реакции (ПЦР), используя структуру праймеров и параметры температурных циклов, описанных в литературе (табл.5).
Смесь для ПЦР содержала 0,5-2,0 мкл специфической пары праймеров с концентрацией 1 о.е./мл, 1,2-1,8 мкл 10´ буфера для амплификации с концентрацией MgCl2 0,5-2,0 mM, 0,5-1,0 е. а. Taq ДНК-полимеразы ("Сибэнзим", "Медиген", Новосибирск) и 100-200 нг геномной ДНК. Смесь помещали в 0,5 мл пробирки типа "Эппендорф", наслаивали сверху минеральное масло для предотвращения испарения и амплифицировали в автоматических минициклерах "MJ Rеsearch" (США) и "БИС 108" (Россия-Новосибирск).
Программа амплификации включала предварительную денатурацию при 94°С в течении 5 минут, с последующими 30-35 циклами отжига при температуре 60°С (1мин.), элонгации цепи при 72°С (40 сек.) и денатурации при 94°С (40 сек.). Программу завершала финальная элонгация при 72°С в течение 3 минут. Амплификат подвергали гидролизу соответствующей рестриктазой (табл.5) при оптимальной для фермента температуре в течении 12-24 ч. Рестрикционная смесь включала 5-7 мкл амплификата, 1,0-1,2 мкл 10´ буфера для рестрикции, поставляемого фирмой – производителем ("Сибэнзим", Новосибирск), и 1-5 единиц активности фермента (в зависимости от эффективности его работы). Продукты рестрикции фракционировали в 3% агарозном геле при напряжении 120 В в течении 30 минут. Фрагменты ДНК окрашивали бромистым этидием и визуализировали в ультрафиолетовом свете.
Таблица 4Структура материала популяционных выборок г. Томска и Томской области, изученных по полиморфным ДНК-маркерам генов NRAMP1, VDR, IL1B, IL12B, IL1RN
| Ген | Полиморфизм | Выборка больных туберкулезом | Выборка здоровых индивидов |
| NRAMP1 | 469+14G/C | 279 | 137 |
| D543N | 278 | 139 | |
| 1465-85G/A | 279 | 135 | |
| 274C/T | 299 | 116 | |
| IL12B | 1188А/С | 279 | 129 |
| VDR | B/b | 293 | 108 |
| F/f | 298 | 113 | |
| IL1B | +3953A1/A2 | 301 | 139 |
| IL1RN | VNTR | 299 | 140 |
Таблица 5 Характеристики исследованных полиморфизмов
| Ген | Полимор-физм | Структура праймеров | tо отжига прай-меров, оС | Фермент рестрик-ции | Продукты гидролиза, п. н. | Литература | |||
| Аллель «дикого» типа | Мутантный аллель | ||||||||
|
| 274C/T | 5’-tgccaccatccctatacccag –3’ 5’-tctcgaaagtgtcccactcag –3’ | 60 | Mnl I | 167;37;12 bp | 102;65;37;12 bp | Liu J. et al., 1995 | ||
| 469+14G/C | 5’-tctctggctgaaggctctcc –3’ 5’-tgtgctatcagttgagcctc – 3’ | 60 | Apa I | 624 bp | 455;169 bp | ||||
| 1465-85G/A | 5’-gcaagttgaggagccaagac –3’ 5’-acctgcatcaactcctcttc –3’ | 60 | Bsе 1I | 142;75;24 bp | 102;75;40;24 bp | ||||
| D543N | 5’-gcatctccccaattcatggt –3’ 5’-aactgtcccactctatcctg –3’ | 60 | Bme 18I | 126;79;39 bp | 201;39 bp | ||||
| IL12 | A1188C | 5’-ttctatctgatttgcttta –3’ 5’-tgaaacattccatacatcc –3’ | 43 | Taq I | 233 bp | 165;68 bp | Hall M. A. еt al., 2000 | ||
| VDR | B/b | 5’-aacttgcatgaggaggagcatgtc-3’ 5’-ggagaggagcctctgtcccatttg-3’ | 60 | Pct I | 813 bp | 505;308 bp | Wilkinson R.J. et al., 2000 | ||
| F/f | 5’-agctggccctggcactgactctgctct-3’ 5’-atggaaacaccttgcttcttctccctc-3’ | 60 | Fok I | 267 bp | 197;70 bp | ||||
| IL1B | +3953A1/A2 | 5’-gttgtcatcagactttgacc-3’ 5’-ttcagttcatatggaccaga-3’ | 58 | Taq I | 220 bp | 148; 72 bp | Wilkinson R.J. et al., 1999 | ||
|
| VNTR | 5’-tcctggtctgcaggtaa-3’ 5’-ctcagcaacactcctat-3’ | 60 | А1-410 п.о. (4 повтора); А2-240 п.о. (2 повтора) А3-500 п.о. (5 повторов); А4-325 п.о. (3 повтора) А5-595 п.о. (6 повторов) | Tarlow J.K. et al., 1993 | ||||
Похожие работы
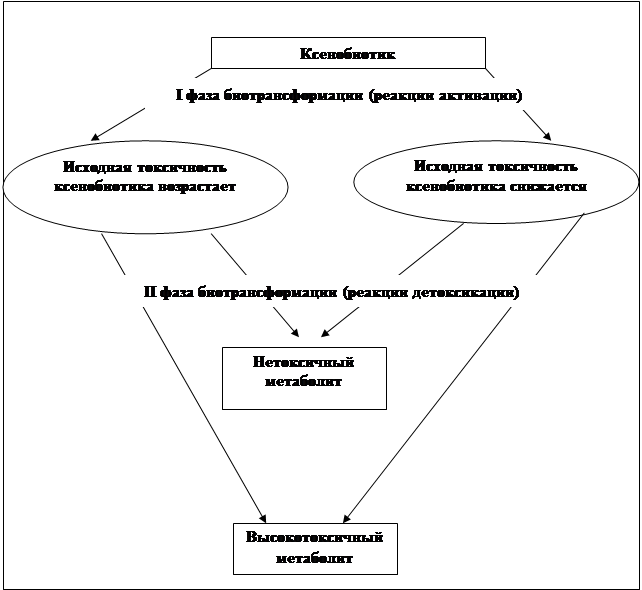
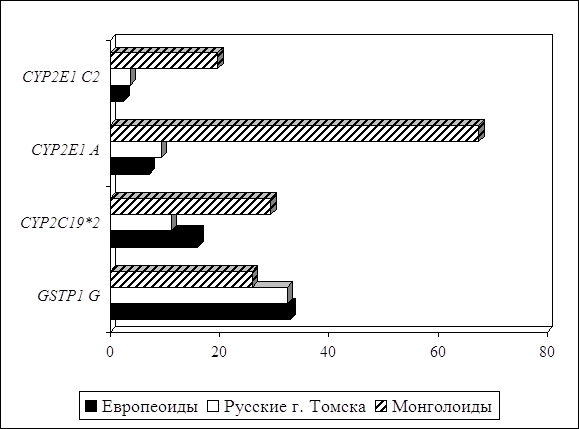
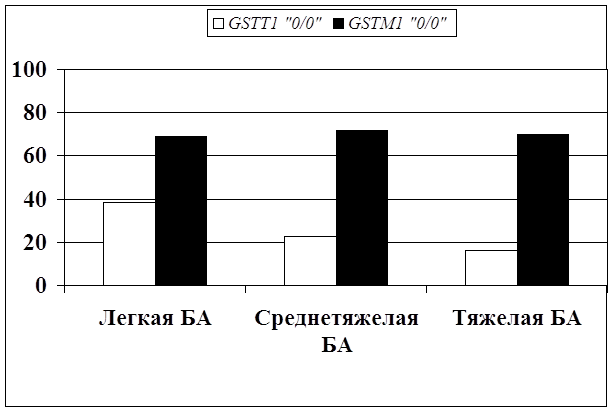
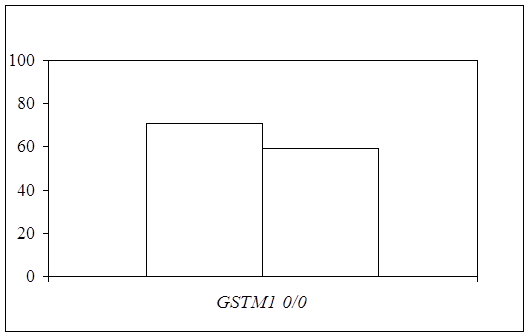
... препаратов. Установлена связь полиморфизма 313A>G гена GSTP1 с изменчивостью уровня аланинаминотрансферазы (р=0,021). 7. Выявлены различия в структуре генетической подверженности к бронхиальной астме и туберкулезу по генам ферментативной системы метаболизма ксенобиотиков: гены GSTM1, CYP2E1 и CYP2C19 связаны с бронхиальной астмой и значимыми для заболевания качественными и ...
0 комментариев