Навигация
Волновые процессы и элементы векторного анализа
БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИНФОРМАТИКИ И РАДИОЭЛЕКТРОНИКИ
Кафедра ЭТТ
РЕФЕРАТ
На тему:
«Волновые процессы и элементы векторного анализа»
МИНСК, 2008
1. Введение. Волновые процессы.
При взаимодействии среды с физическими полями и упругими материальными объектами, в средах возникают возмущения. Одним из таких возмущений являются волны.
Волны представляют собой изменения состояния среды (возмущения), распространяющиеся в этой среде и несущие с собой энергию, без переноса вещества. Математически процесс распространения волн описывается с помощью волнового уравнения. В наиболее общем виде волновое уравнение записывается:
![]() (1.)
(1.)
Где t-время; x, y, z –пространственные декартовые координаты, W=W(x,y,z,t)-функция возмущения среды в точке с координатами x,y,z в момент времени t, с- параметр, характеризующий скорость, которая в предельном случае достигает скорости света, - оператор Д’Аламбера (даламбериан); Δ- оператор Лапласа (лапласиан).
Частными видами волнового уравнения является двухмерное и одномерное волновые уравнения. Волновое уравнение допускает разделение переменных по координатам и времени: W=W(x, y, z,) φ(t). В представленном виде волновое уравнение называют неоднородным, т.к. в его правой части стоит заданная функция координат и времени, т.е. W=f(x,y,z,t).
Для рассмотрения задач квантовой механики, изучающей законы движения частиц в области микромира (в масштабах- 10-6-10-13 см. со скоростями как меньше v<<c, так и сравнимых со скоростью света v≈c), в 1926 году Эрвином Шредингером было предложено новое уравнение. Он в волновое уравнение ввел постулат де Бройля λ=h/p. Это известное сегодня уравнение Шредингера:
![]() (2.)
(2.)
Где h- постоянная планка; m- масса частицы; ψ- волновая функция частицы, U- потенциальная энергия частицы, ![]() - оператор Лапласа.
- оператор Лапласа.
Строгое решение уравнения (2) сегодня осуществлено только для атома водорода, что позволяет считать вычисленные при решении уравнения Шредингера для атома водорода волновые функции точными. Но уже для двух электронного атома, имеющего электронную конфигурацию 1S2 точное решение уравнения Шредингера принципиально невозможно. Запишем выражение для потенциальной энергии атома гелия:
![]() (3.)
(3.)
Здесь Z=2, заряд ядра; первые два числа учитывают притяжение первого и второго электрона ядром, третий член выражает часть потенциальной энергии, обусловленной взаимным отталкиванием электронов. Для многоэлектронных атомов с числом электронов больше двух точное решение уравнения Шредингера невозможно, поскольку в гамильтониан H полной энергии атома с n электронами и соответствующим зарядом ядра:
![]() (4.)
(4.)
входят не только оператор кинетической энергии и оператор потенциальной энергии для электронов, притягиваемых ядром, но и оператор энергии отталкивания электронов друг от друга. Так как последний оператор имеет противоположный знак, исключается возможность разделения переменных и становится принципиально невозможным точное решение уравнения Шредингера для многоэлектронных атомов.
Все дальнейшие попытки рассмотрения квантово механических многоэлектронных систем основано на использовании различных приближений методов и моделей. Наибольшее распространение получила модель водородоподобных атомов. На основе этой модели в одноэлектронном приближении для многоэлектронных атомов рассматривается взаимодействие одного внешнего электрона с ядром, заряд которого экранирован всеми остальными внутренними электронами. Подчеркнем, что в данной модели предполагается, что остальные электроны равномерно экранируют заряд ядра во всех направлениях. Константе экранирования σ учитывает это экранирование:
Zэф=Z-σ
В этой модели соответствующие орбитали отличаются от орбиталей атома водорода радиальными составляющими R(r), но имеют идентичные угловые составляющие Ve,m и следовательно формы s-,p-,d-,f- орбиталей будет такой же как и у атома водорода. Этот расчет многоэлектронных атомов, основанный на работах Слетера, называется водородоподобным. Дальнейшее более точное приближение основано на работах Хартри и Фокса. В этом приближении учитывается усредненное отталкивание одного данного электрона от каждого из остальных электронов. Волновые функции атома в методе Хартри-Фокс представляют собой произведение водородоподобных волновых функций.
Похожие работы
... энергии одного электрона на их максимальное число, соответствующее определенному энергетическому уровню. Таким образом, мы выходим на представление о существовании в каждом атоме одной или нескольких изоэнергетических поверхностей, которые следует отнести к наиболее сохраняющимся физическим величинам. По всей видимости, эта новая не совсем привычная величина определяет те внешние пространственные ...
... связано с появлением вероятностного мышления, теории относительности, принципа многозначных зависимостей. В рамках преодоления линейного подхода находятся социально-философские концепции XX в. с различными критериями членения исторического процесса. П. Сорокин признавал всеобщую реальность, проявляющуюся в многообразных материально-духовных формах. Исторический процесс, в концеп ции Сорокина, ...
... q расстояние между линиями увеличивается. Это обстоятельство в дальнейшем будет для нас существенно. Лекция 4 25 Лекция 4 4. Законы геометрической оптики 4.1. Прямолинейность распространения света. Принцип Ферма Физика в разных своих разделах часто занимается вопросами весьма несхожими. В частности оптика никак не представляется логическим продолжением предыдущих разделов, которыми мы с Вами ...
... (7.2.15.) Поскольку в рассматриваемой задаче рассматривается только один источник, то учитываем только волну с амплитудой А. В пространстве имеются 2 взаимно перпендикулярных поля ( Е и Н). Как определить направление переноса энергии ? Пср = ...
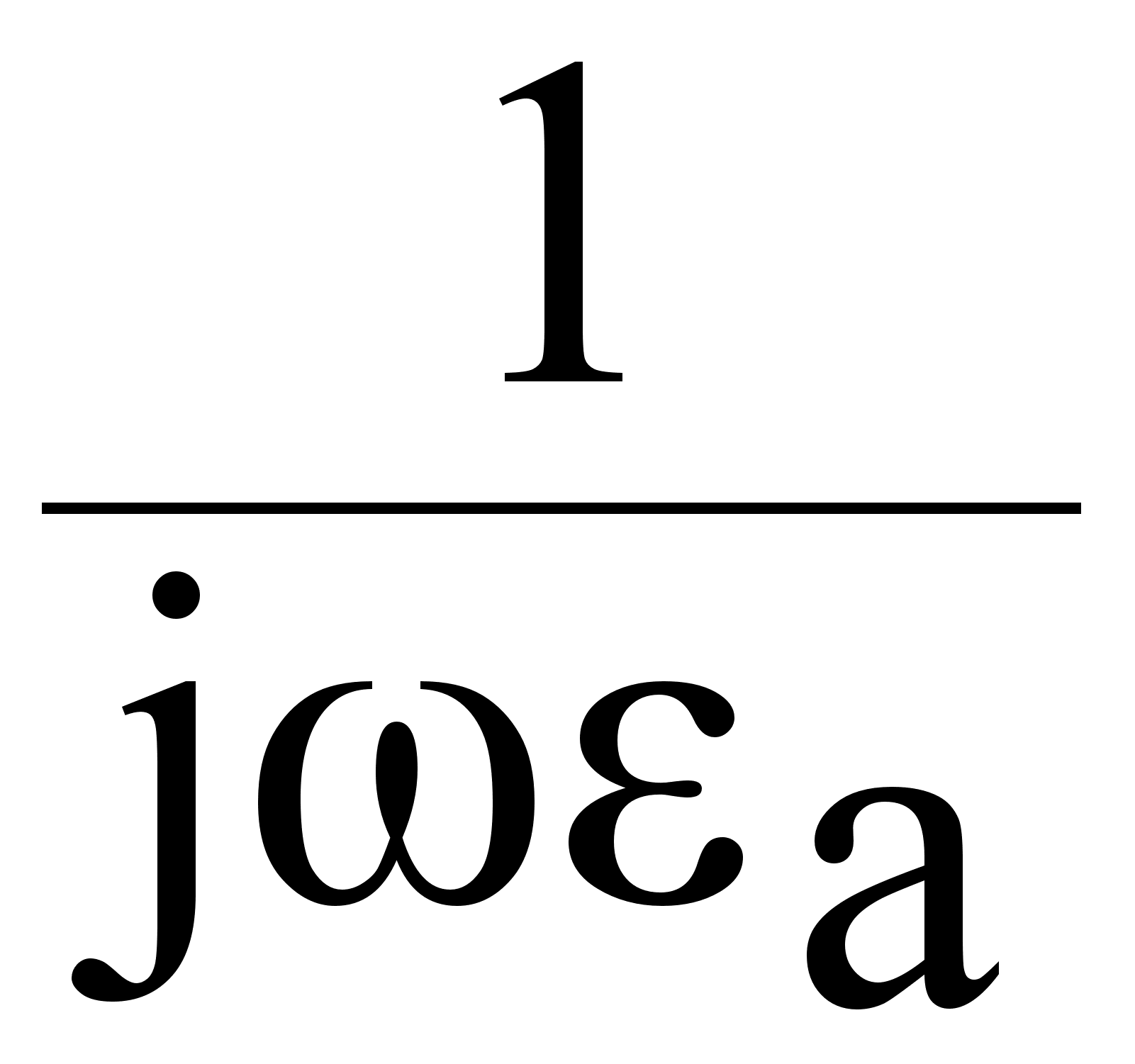
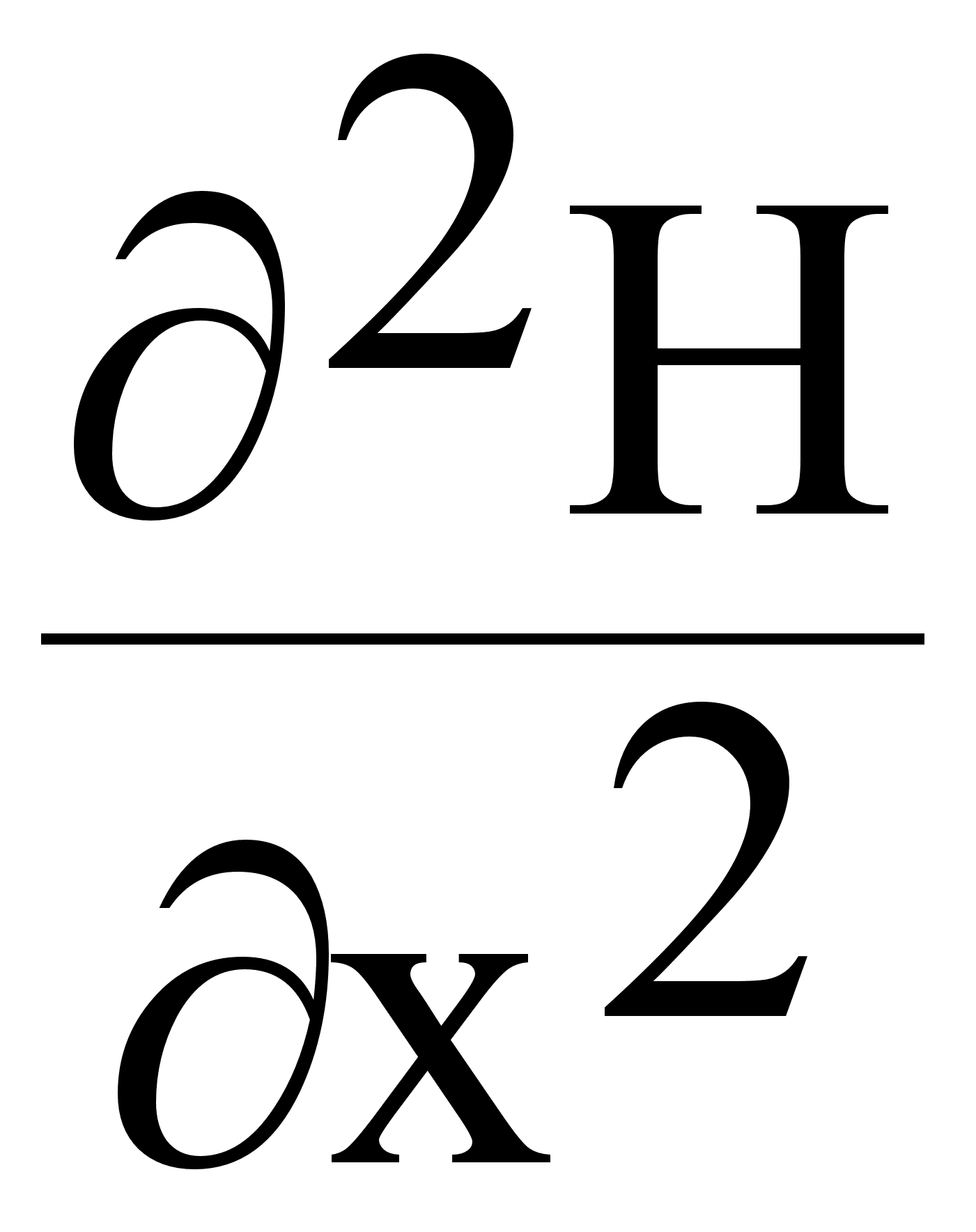
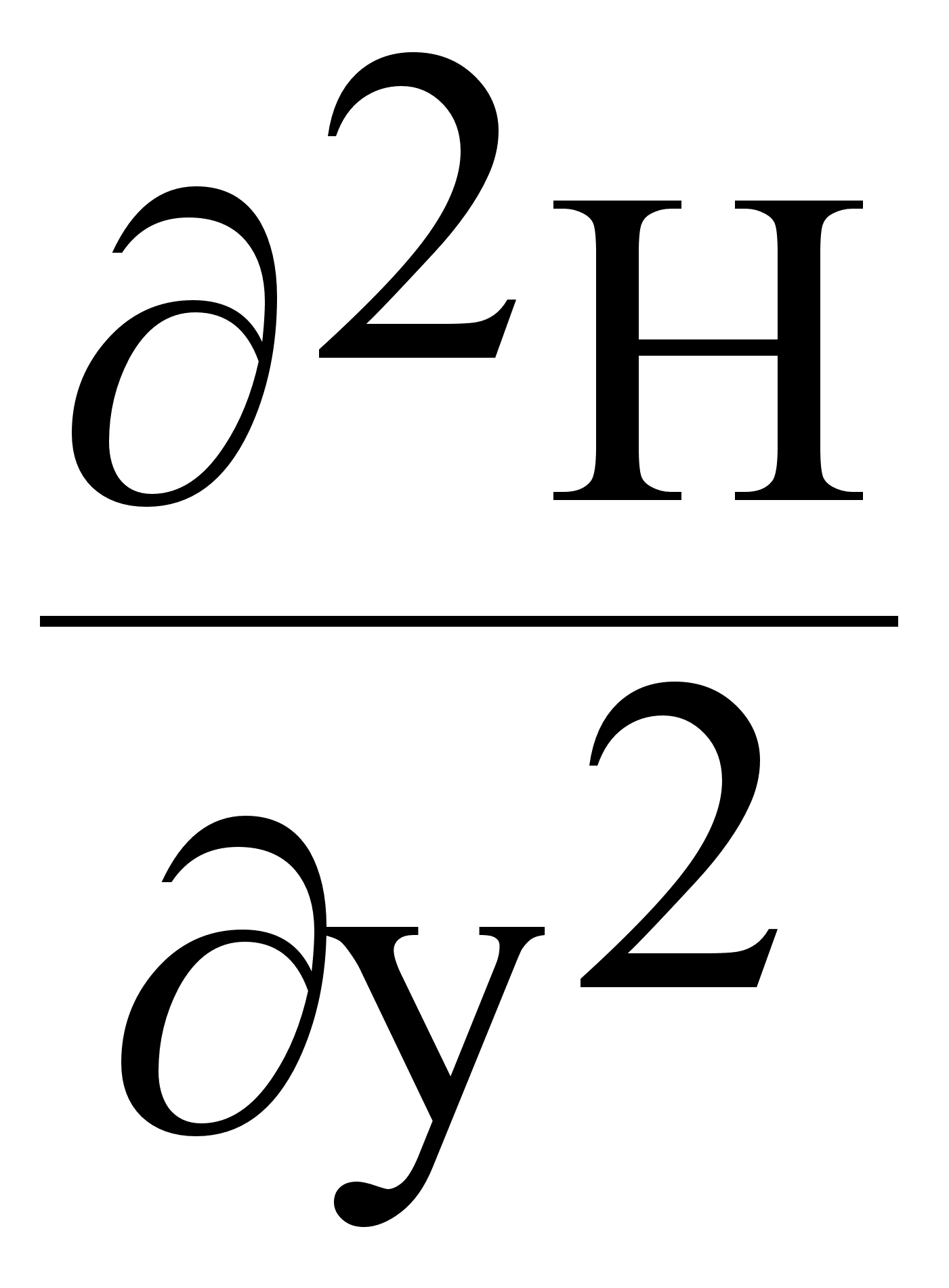
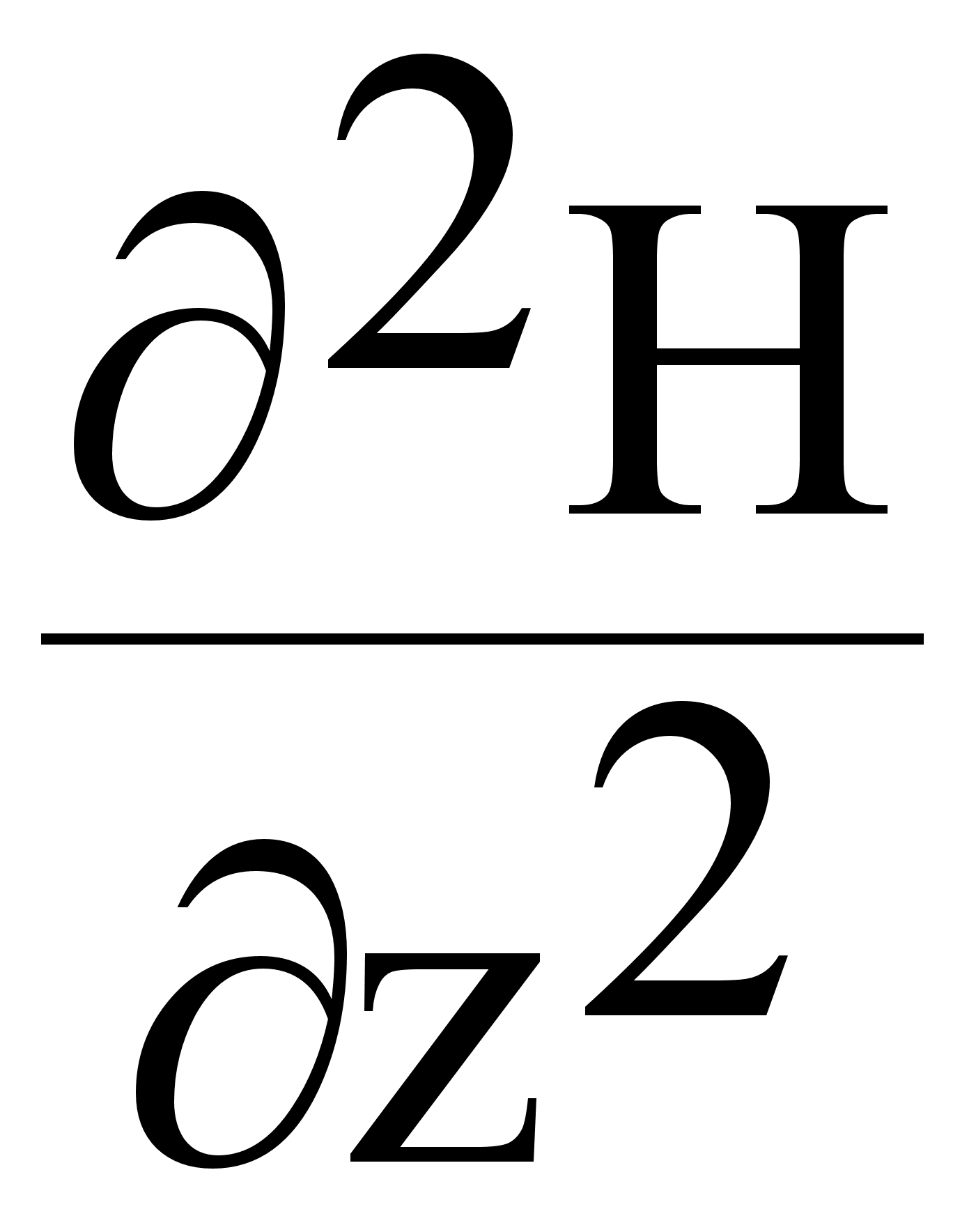
0 комментариев