Навигация
4. Точкові дефекти.
Частина атомів або іонів може бути відсутньою на місцях, відповідних ідеальній схемі грат. Такі дефектні місця називаються вакансіями.
4.1 Вакансії
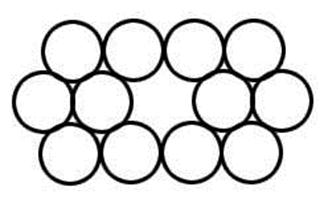
Вакансія, дефект за Шоткою, дефект кристала, що є відсутністю атома або іона у вузлі кристалічної решітки (рис. 7).
|
|
| Рис. 7. Грати кристала з вакансією. |
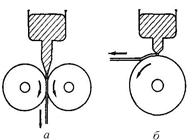
Вакансія є у всіх кристалах, як би ретельно ці кристали не вирощувалися. У реальному кристалі вакансії виникають і зникають в результаті теплового руху атомів. Механізм утворення вакансій можна представити як вихід атомів поверхневого шару на поверхню з подальшим переходом виникаючих поверхневих «дірок» (рис. 8 а, б, в).
При цьому замість зв'язку з трьома сусідніми атомами залишається лише один зв'язок, а дві інші розриваються. Отже, робота, необхідна для утворення вакансії, рівна енергії двох зв'язків.
Вакансії безладно переміщуються в кристалі, обмінюючись місцями з сусідніми атомами. Рух вакансій є головною причиною перемішування (самодифузії) атомів в кристалі, а також взаємній дифузії контактуючих кристалів. Кожній температурі відповідає певна рівноважна концентрація вакансій. Кількість вакансій у кристалах металів поблизу температури плавлення досягає 1—2% від числа атомів.
При кімнатній температурі в алюмінію одна вакансія припадає на 1012 атомів, а в таких металів, як срібло і мідь, кількість вакансій при кімнатній температурі ще менша. Проте, не дивлячись на малу концентрацію, вакансії істотно впливають на фізичні властивості кристала: знижують щільність, викликають іонну провідність і ін. Вакансії відіграють важливу роль в процесах термообробки, спіканні і інших процесах.
У кристалах можуть бути присутніми чужорідні (домішкові) атоми або іони, які заміщують основні частинки, що утворюють кристал, або вміщуються між ними. Точковими домішками у кристалах є також власні атоми або іони, що змістилися з нормальних положень (міжвузлові атоми і іони), а також центри забарвлення — комбінації вакансій з електронами провідності (F-центри), з домішковими атомами і електронами провідності (Z-центри) або з дірками (V-центри). Центри забарвлення можуть бути викликані опроміненням кристалів.
4.2 Центри забарвлення
Центри забарвлення – дефекти кристалічної решітки, що поглинають світло в спектральній області, в якій власне поглинання кристала відсутнє. Спочатку термін «центи забарвлення» відносився тільки до так-званих F-центрів (від нім. Farbenzentren), які було виявлено вперше в 30-х рр. в лужно-галогенних кристалах Р. В. Полем із співробітниками (Німеччина) і що є аніонні, такі, що захопили електрон [модель французького ученого де Бура, підтверджена експериментально і теоретично розрахована С. И. Пекаром (СРСР)]. Надалі під центрами забарвлення стали розуміти будь-які точкові, такі, що поглинають світло поза областю власного поглинання кристала — катіонні і аніонні вакансії, міжвузлові іони (власні центри забарвлення), а також домішкові атоми і іони (домішкові центри). Центри забарвлення виявляються у багатьох неорганічних кристалах і в склі; вони широко поширені в природних мінералах.
Власні центри забарвлення можуть бути створені дією іонізуючого проміння і світла, що відповідає області власного поглинання кристала (фотохімічне фарбування). Такі центри забарвлення називаються наведеними. При фотохімічному фарбуванні нерівноважні носії заряду (електрони провідності і дірки), що виникли під дією випромінювання, захоплюються дефектами кристала і змінюють їх заряд, що зумовлює появу нових смуг в спектрі поглинання і зміну забарвлення кристала. Зазвичай з'являється принаймні 2 типи центрів забарвлення — із захопленим електроном (електронний центр забарвлення) і діркою (дірковий центр забарвлення). Якщо частинки або фотони, що породжують фарбування, несуть чималу енергію, то вони можуть утворювати нові дефекти, які теж зазвичай виникають парами (наприклад, вакансія — міжвузловий іон). Наведені центри забарвлення можуть бути зруйновані при нагріванні (термічне знебарвлення) або дії світла, відповідного спектральній області поглинання самих центрів забарвлення (оптичне знебарвлення). Під дією тепла або світла один з носіїв заряду, наприклад електрон, звільняється з дефекту, що захопив його, і рекомбінує з діркою. Такий процес може супроводжуватися, якщо енергія, що виділилася при цьому, випускається у вигляді кванта світла. Під дією тепло може зникати і пари дефектів (наприклад, міжвузловий атом може заповнити відповідну вакансію). В цьому випадку люмінесценція, як правило, не спостерігається — вся енергія, що виділилася, перетворюється на тепло.
При іншому способі утворення власних центрів забарвлення, так-званому адитивному фарбуванню носії заряду, необхідні для створення центрів забарвлення, вносяться до кристала ззовні, а не утворюються в ньому самому (звідси термін «адитивне фарбування», тобто фарбування при додаванні чого-небудь). Це досягається прогріванням в парах металу або введенням електронів в нагрітий кристал із загостреного катода, або ж за допомогою електролізу. При прогріванні в парах металу атоми металу дифундують всередину кристала, заповнюють катіонні вакансії і, віддаючи свої електрони аніонним вакансіям, утворюють F-центри. В деяких випадках (наприклад, у випадку флюорита) власні центри забарвлення можуть виникати в процесі кристалізації. Центри забарвлення, що утворюються при адитивному фарбуванні і кристалізації, не можуть бути знищені термічно або оптично — для їх руйнування потрібні інші дії. Так адитивно забарвлені лужно-галогенні кристали знебарвлюються при нагріванні в атмосфері галогену; флюорит вдалося одержати нефарбованим, змінивши умови кристалізації.
Якнайповніше F-центри вивчені в лужно-галогенних кристалах, але виявлені вони і в інших кристалах. F-центр в лужно-галогенних кристалах обумовлює селективну смугу поглинання дзвонеподібного вигляду (F-смугу), зазвичай, у видимій області спектру, що зміщується для кристалів з однаковими аніонами (катіонами) і різними катіонами (аніонами) у бік довгих хвиль при збільшенні атомної ваги катіона (аніона). Наприклад, в NACI F-смуга має максимум поглинання в синій області спектру (![]() = 465 нм) і колір кристала — жовто-коричневий (додатковий колір), в KCl — в зеленій області (
= 465 нм) і колір кристала — жовто-коричневий (додатковий колір), в KCl — в зеленій області (![]() = 563 нм) і кристал виглядає фіолетовим.
= 563 нм) і кристал виглядає фіолетовим.
У лужно-галогенних кристалах виявлені і інші складніші власні центри забарвлення — F-агрегатні електронні центри: F2 (або М), F3 (або R), F4 (або N), є відповідно два, три і чотири зв'язані F-центри (тобто дві, три або чотири аніонні вакансії, що захопили 2,3,4 електрона); F2+, F3+ — іонізовані F2- і F3-центри і ін. Діркові центри в лужно-галогенних кристалах представлені молекулярними іонами галогену (наприклад, Cl), що захопили дірку (тобто що віддали один електрон) і зайняли положення двох нормальних іонів (Vk-центр) або положення одного іона (Н-центр), які можуть знаходитися у поєднанні з вакансією сусіднього катіона (VF-центр) або двох катіонів (Vt-центр).
Домішкові центри забарвлення — чужорідні атоми або іони, упроваджені в кристал, скло або іншу основу. У кристали для утворення домішкових центрів забарвлення домішка вводиться в розплав або розчин в процесі кристалізації або ж шляхом дифузії в готовий кристал. Домішкові атоми і іони так само, як і ін. точкові дефекти, можуть захоплювати електрон або дірку, внаслідок чого змінюють смугу поглинання кристала і його забарвлення. Наведені домішкові центри забарвлення виникають в кристалах і аморфних тілах, що містять домішки, при фотохімічному фарбуванні завдяки зміні заряду домішки. В більшості випадків іони домішок, що входять в наведені центри забарвлення, мають валентність, відмінну від іонів основи. Так, наприклад, в кристалі KCl з домішкою Tl домішковий центр забарвленя — іон Tl+, а наведені домішкові центри забарвлення — атоми Tl і іони Tl2+; у рубіні (Al2O3 з домішкою Cr) домішковий центр забарвлення — іон Cr3+, наведені домішкові центри забарвлення — іони Cr2+ і Cr4+. Всі наведені центри забарвлення можуть бути зруйновані оптично або термічно.
У кристалах з домішками виявлені також центри забарвлення змішаного типу: FA-центри і Z-центри. Перші є F-центрами, розташованими поряд з іоном домішки (активатором), другими (у лужно-галогенних кристалах), — F-центрами, пов'язаними з вакансіями і з двовалентними домішковими іонами (Ca, Sr). Спостерігаються також складні домішкові центри забарвлення, що складаються з двох або більше за частинками домішок одного або різних сортів. Наприклад, в лужно-галогенних кристалах виявлені домішкові центри забарвлення, пов'язані з впровадженням іонів (О-, O2-, S2-, S3-, SO2-, PO42-, CO32- і ін.). Центри забарвлення під впливом зовнішніх дій (світло, тепло, електричне поле) можуть коагулювати, утворюючи так-звані колоїдні центри.
Центри забарвлення , будучи центрами захоплення електронів і дірок, можуть служити центрами люмінесценції. Найбільш ефективним методом дослідження центрів забарвлення є електронний парамагнітний резонанс у поєднанні із спектральними дослідженнями, що дозволяє розшифрувати будову центрів забарвлення.
Фарбування і знебарвлення кристалів і аморфних тіл широко застосовується в науковому експерименті і в техніці. Воно використовується в дозиметрії ядерних випромінювань, в обчислювальній техніці (пристрій для зберігання інформації), в пристроях, де застосовуються фотохромні матеріали (сонцезахисні скельця, що темніють під дією сонячного світла і прояснюються в темноті) і ін. У археології і геології по дослідженнях центрів забарвлення, що виникли під дією випромінювання радіоактивних елементів, що знаходяться в товщі Землі, визначають вік глиняних виробів і мінералів. Забарвлення ряду коштовних каменів і самоцвітів пов'язане з центрами забарвлення (аметист, цитрин, алмаз, амазоніт і ін.). Деякі кристали і стікла з домішковими центрами забарвлення використовуються як активне середовище в лазерах (рубін, скло з домішкою Nb та ін.).
У іонних кристалах, утворених частинками двох сортів (позитивними і негативними), точкові дефекти виникають парами. Дві вакансії протилежного знаку утворюють дефект за Шотою. Пара, що складається з межвузлового іона і залишеної ним вакансії, називається дефектом по Френкелю.
Атоми в кристалах розташовуються на рівній відстані один від одного рядами, витягнутими вздовж певних кристалографічних напрямів. Якщо один атом зміститься з свого положення під ударом частинки, що налетіла, викликаної опроміненням, він може, у свою чергу, змістити сусідній атом і т.д.
Таким чином зміщеним виявиться цілий ряд атомів, причому на якомусь відрізку ряду атомів один атом виявиться зайвим. Таке порушення в розташуванні атомів або іонів уздовж певних напрямів з появою зайвого атома або іона на окремій ділянці ряду називається краудіоном.
Опромінення виводить з положення рівноваги атоми або іони і в інших напрямах, причому рух передається по естафеті все більш далеко віддаленим атомам. У міру видалення від місця зіткнення частинки, що налетіла, з атомом кристала передача імпульсу виявляється локалізованою (сфокусованою) уподовж найбільш щільно упакованих напрямів.
Така естафетна передача імпульсу частинки, що налетіла, іонам або атомам кристала з постійним фокусуванням імпульсу уподовж щільно упакованих атомних рядів називається фокусоном.
4.3 Іонні кристали
Іонні кристали, кристали, в яких зчеплення частинок обумовлене переважно іонними хімічними зв'язками. Іонні кристали можуть складатися як з одноатомних, так і з багатоатомних іонів. Приклади іонних кристалів першого типу — кристали галогенідів лужних і лужноземельних металів, утворені позитивно зарядженими іонами металу і негативно зарядженими іонами галогену (NaCl, CsCl, CaF2, див. рис. 9.).
Приклади іонних кристалів другого типу — нітрати, сульфати, фосфати, силікати і ін. солі цих же металів, де негативні іони кислотних залишків складаються з декількох атомів. Кислотні залишки можуть об'єднуватися в довгі ланцюги, шари, а також утворюють тривимірний каркас, в порожнечах якого розміщуються іони металу. Такі утворення зустрічаються, наприклад, в кристалічних структурах силікатів.
Похожие работы
... термічне і іонно-плазмове розпилювання, хімічне і електрохімічнео садження, гарт з рідкого стану і механічне легування (механо-активований синтез).[4] ІІІ. МЕТОДИ ОДЕРЖАННЯ АМОРФНИХ МЕТАЛІВ 3.1 Методи розпилювання Методи розпилювання, що застосовуються для швидкого загартування з розплаву, розрізняються по механізму розпилювання і за способом охолоджування крапель, що утворюються. ...
... - ця зварювання нагадує зварювання штучними електродами, тому що склад шихти може бути підібраний аналогічно обмазці електродів і дозволяє не тільки захищати розплавлений метал, але і легувати його, що практично неможливо при зварюванні під флюсом і в захисних газах. 2.1.1 Технологія зварювання вугільними і графітовим електродом Вугільні електроди складаються з аморфного електротехнічного вугі ...
... впливу технологічних факторів, що вивчаються, на ступінь ураженості злитку усадковою раковиною та розвитком окремих зон кристалізації. Таблиця 2.1Результати експериментів № п.п. Фактори технології розливки Найменування параметрів % Усадкової раковини Примітка (характеристика зон кристалізації) 1 Форма виливниці З розширенням уверх З розширенням униз 2 ...
... предметів туалету й ін. Томпак – сплав міді з цинком (10-12%). Застосовують для виготовлення ювелірної галантереї, стопок і інших побутових предметів. Існує кілька класифікацій ювелірних каменів. У торгівлі і промисловості ювелірні камені класифікують по їхній відносній цінності на дорогоцінні, напівкоштовні і виробні. Дорогоцінні і напівкоштовні камені звичайно прозорі, вироблені – непрозорі ...


0 комментариев