Навигация
3.3.1. Вращательные движения определяют важнейшие черты стационарных состояний электронных оболочек и ядер aтомов и молекул. Некоторые приемы теоретического анализа состояний атомно-молекулярных систем особенно наглядно можно исследовать на примере простейшей модели вращения – плоского ротатора. Мы уже рассмотрели замену комплексных орбиталей действительными волновыми функциями, допускающими наглядное графическое представление. Следующий прием - построение гибридных орбиталей, каждая из которых уже не обладает центральной симметрией, а напротив, отличается ярко выраженной концентрацией в некотором выделенном направлении. Заглядывая вперед, отметим, что гибридные электронные орбитали атомов играют важнейшую роль в образовании химических связей.
Эффект гибридизации позволяет наглядно проиллюстрировать применение принципа суперпозиции состояний, чрезвычайно важного для химии и для всей квантовой механики.
3.3.2. Гибридизация – это смешение состояний с различными значениями момента импульса. Например, гибридные орбитали можно образовать из волновых функций σ- и π-типа, но из орбиталей только π-типа – нельзя.
Смешивая орбитали разных уровней, удается построить гибкие формы орбиталей, пригодные для описания каких-либо физических или химических явлений, рассмативая их как возмущение исходных состояний системы. С этой целью образуют линейные комбинации из волновых функций, принадлежащих различным уровням. Энергии гибридизующихся орбиталей различаются, но это отличие должно быть невелико.
3.3.3. На основе исходного набора волновых функций – тройки орбиталей (![]() ), принадлежащих двум низшим ypoвням плоского ротатора, возможны два предельных способа построения гибридов. В первом из них гибридизуются только σ- и лишь одна из двух π-орбиталей, тогда как вторая остается несмешанной. Например, образуем ниже гибрид из σ- πс, не затрагивая πs. Назовем этот тип смешения σπ-гибридизацией. Во втором случае смешиваются все три исходные орбитали, т.е. происходит σπ2-гибридизация. Число гибридных функций всегда равно числу исходных смешивающихся орбиталей.
), принадлежащих двум низшим ypoвням плоского ротатора, возможны два предельных способа построения гибридов. В первом из них гибридизуются только σ- и лишь одна из двух π-орбиталей, тогда как вторая остается несмешанной. Например, образуем ниже гибрид из σ- πс, не затрагивая πs. Назовем этот тип смешения σπ-гибридизацией. Во втором случае смешиваются все три исходные орбитали, т.е. происходит σπ2-гибридизация. Число гибридных функций всегда равно числу исходных смешивающихся орбиталей.
В обоих случаях исходные орбитали образуют ортонормированный базисный набор (2.4) или кратко базис, и в этом смысле совершенно подобны некоторым единичным векторам. Орбитали базисного набора удобно представить в упорядоченном виде вектора-столбца или вектора-строки, вводя при этом унифицированные обозначения
![]() ,
,
или равноценно
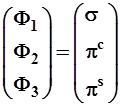 , где
, где ![]()
3.3.4. Образование гибридных орбиталей представляет собой смешение исходных базисных орбиталей, т.е. их линейную комбинацию. Численные коэффициенты при базисных функциях определяют их вклады в составе гибрида и, как правило, находятся из простых соображений.
Возможные варианты образования ортонормированных гибридных орбиталей представим схемой:
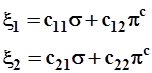 (3.42)
(3.42) 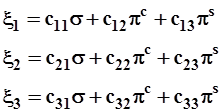 (3.43)
(3.43)
В матричной форме эти выражения примут вид:
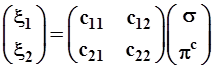
 (3.44)
(3.44)
Для каждой из гибридных i-орбиталей алгебраическая связь между коэффициентами при компонентах ортонормированного базиса (в нашем случае ![]() ) идентична обычной связи между проекциями ортонормированных векторов:
) идентична обычной связи между проекциями ортонормированных векторов:
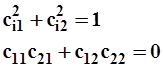 для i=1, 2
для i=1, 2 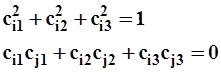 i=1, 2, 3, j ≠ i
i=1, 2, 3, j ≠ i
Согласно постулату 4 (уравнение 2.29) квадраты коэффициентов наделены определенным смыслом. Каждый из них определяет вероятность “чистого” исходного состояния в составе смешанного.
3.3.5. Для простоты и определенности образуем такие гибриды, при смешении 2-х волновых функций (σ и πс), вес каждой из них в составе гибридных орбиталей одинаков, т.е. равен 1/2:
![]() .
.
Последнее соотношение приводит к выводу:
![]() (3.45)
(3.45)
откуда для разных значений i=1, 2 получаем равноценные возможности, т.е. два вектора

Следовательно, гибридные орбитали имеют вид:
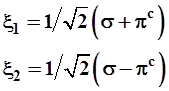 (3.46)
(3.46)
Подставив в (3.46) явные выражения базисных векторов (336) и (3.40), получим гибридные орбитали как функции полярного аргумента:
![]() (3.47)
(3.47)
На полярных графиках гибридных орбиталей (рис. 6) наглядно представлена их ориентированность. Основная часть каждой орбитали сконцентрирована в больших лепестках, противоположно направленных в разные стороны от полюса – центра вращения.
3.3.6. Рассмотрим теперь более сложный случай σπ2-гибридных орбиталей. Полагая ![]() и выбирая для сi1 арифметическое значение корня, т.е.
и выбирая для сi1 арифметическое значение корня, т.е. ![]() , мы неизбежно сохраняем свободу выбора значений сi2 и сi3, которая ограничена только условием
, мы неизбежно сохраняем свободу выбора значений сi2 и сi3, которая ограничена только условием
![]() .
(3.48)
.
(3.48)
Введем тригонометрическую постановку, удовлетворяющую условию (3.48):
![]() ,
, ![]() . (3.49)
. (3.49)
Тогда общее выражение для гибридных орбиталей примет вид:
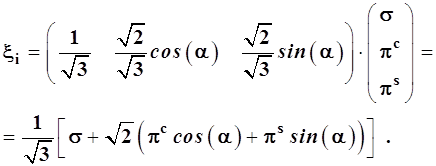 (3.50)
(3.50)
Линейная комбинация орбиталей πс и πs в составе ξi представляет собой также πс-орбиталь, ось которой повернута под углом к исходному координат-ному лучу, так как:
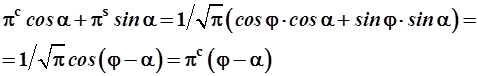 . (3.51)
. (3.51)
На этом основании из (3.50) получается общая формула для σπ2-гибридных волновых функций:
![]() ; i=1, 2, 3
; i=1, 2, 3
Один из трех углов αi можно выбрать произвольно, но остальные будут определяться из условия ортогональности гибридных орбиталей. Без потери общности положим α1=0 и получим
![]() ,
(3.53)
,
(3.53)
![]() .
(3.54)
.
(3.54)
Найдем углы α2,3, используя ортогональность гибридных функций (1.14):
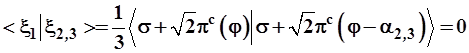
Откуда следует
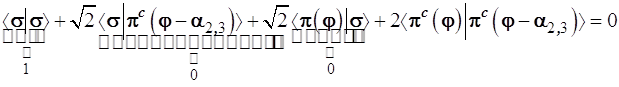 и с учетом ортонормированности базиса, т.е. ‹σ|σ›=1; ‹σ|πс›=0 (независимо от ориентации πс-функции) получаем уравнение:
и с учетом ортонормированности базиса, т.е. ‹σ|σ›=1; ‹σ|πс›=0 (независимо от ориентации πс-функции) получаем уравнение:
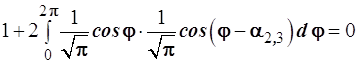
Совершим равносильные преобразования
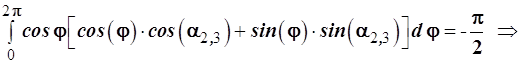
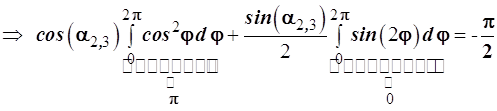
В итоге получаем искомое тригонометрическое уравнение
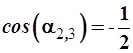 и (3.57)
и (3.57)
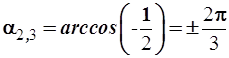 .
(3.58)
.
(3.58)
Таким образом, все три гибридные орбитали ориентированны вдоль трех лучей, направленных под углом 1200 друг к другу.
Похожие работы
... детерминант и диаграмма уровней. Хюккелевский детерминант треугольного цикла. X 1 1 1 X 1 = 0; ® X3+2-3X=0; ® X1,2,3= -2; +1; +1; ® E1,2,3=+2 1 X два решения одинаковы – уровень дважды вырожден Молекулярные орбитали дважды-вырожденного уровня треугольного цикла. Базисные АО =2p(C) j1=(p1+p2+p3)/31/2 невырожденный уровень AСвязывающий основной j2=(p1+p2-2p3)/61/2 j3=(p1-p2)/21/2 ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
... различия в природе связей между атомами углерода ( боковое перекрывание, прочность, доступность для реагентов), проводит сравнение с одинарной С-С связью в этане ( длина связи 0,154 нм). Третье валентное состояние атома углерода. Учитель, говорит, что существуют органические вещества, в которых атом углерода связан только с двумя соседними атомами. Это ацетилен. В этом соединении атомы углерода ...
... . (фторид натрия состоит из ионов натрия Na+ и фторид-ионов F-) Если разность электроотрицательностей атомов велика, то электронная пара, осуществляющая связь, переходит к одному из атомов, и оба атома превращаются в ионы. Химическая связь между ионами, осуществляемая за счет электростатического притяжения, называется ионной связью. Водородная связь. Водородная связь - зто связь между ...





0 комментариев