Навигация
Образование азокрасителей [1, с. 93]
1.1.5.1 Образование азокрасителей [1, с. 93]
Образование промежуточной соли диазония при взаимодействии нитрита с сульфаниловой кислотой происходит по реакции:
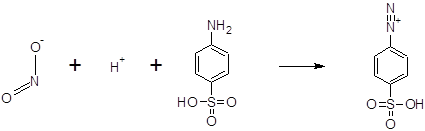
Для сочетания с образовавшейся солью диазония с целью получения азокрасителя используются многие первичные ароматические амины, наиболее часто – 1-нафтиламин:
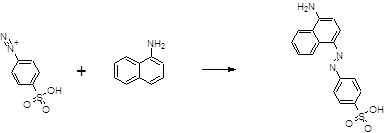
Образуется 1-(4-аминонафтилазо)-бензол-4-сульфоновая кислота – краситель красного цвета. Реакция весьма специфична и чувствительна, позволяет обнаружить 3 мкг/л NO2-. Условия проведения этих реакций: диазотирование должно проводится в сильнокислых растворах на холоду, сочетание должно быть проведено только после того, как полностью закончится диазотирование и при возможно более низкой кислотности. Это должно быть учтено при подготовке реактивов (сульфаниловой кислоты и 1-нафтиламина). Точное установление рН для реакции сочетания достигается использованием раствора ацетата натрия. Оптическую плотность образовавшегося красителя измеряют при 520 нм в кювете с толщиной слоя 1см.
1.1.5.2 Образование солей диазония [4]
Растворы солей диазония, образующихся в методе с сульфаниловой кислотой, чрезвычайно сильно поглощают в УФ-области, что используется для определения нитрита. Измерения проводятся при 270 нм в 1-сантиметровой кювете. Закон Бера соблюдается в интервале концентраций 0,2-3,2 мг/мл NO2-.
Соли диазония, образовавшиеся из фенилендиамина и многих его производных, были использованы для определения нитритов. Чувствительность при этом в 3-4 раза больше, чем с солями, образованными из сульфаниловой кислоты. Особенно пригоден хлор-п-фенилендиамин, так как он дает хорошо воспроизводимые результаты и стабилен во времени.
1.1.5.3 Образование нитрозосоединений, окрашенных и флуоресцирующих комплексных соединений [4]
Для фотометрического определения нитритов используется реакция с N,N-диметиланилином, в результате которой образуется нитрозосоединение желтого цвета (п-нитрозо-N,N-диметиланилин):

Метод позволяет определить до 1 ppm NO2-.
Реакция с 2,6-ксиленолом. В растворах с оптимальной кислотностью (серная кислота-вода-уксусная кислота 5:4:1 ) при реакции 2,6-ксиленола с HNO2 образуется 4-нитрозо-2,6-ксиленол, светопоглощение которого при 307нм пропорционально концентрации NO2- в диапазоне 0-10 мкг\мл. Мешают галогениды и их необходимо удалить осаждением раствором Ag2SO4.
Реакция с тиогликолевой кислотой. При взаимодействии нитрита с тиогликолевой кислотой в слабокислой среде образуется нитрозотиогликолевая кислота.
Это нитрозосоединение используется для колориметрического определения NO2- в интервале концентраций 10-100 мг\л. Мешают ионы Fe(II) (при соотношении Fe:NO2- > 50), Co(II), MnO4-, WO42-.
Реакция с бруцином. Разработан быстрый колориметрический метод с использованием бруцина в качестве хромофорного реагента в растворе серной кислоты.
Ионы NO2- дают окрашенные соединения в более разбавленной кислоте, чем ионы NO3- ( 1:5 и 1:1 соответственно).
На этой основе разработан метод фотометрического определения NO2- в щелочных растворах.
Реакция с риванолом. Нитрит-ионы образуют интенсивную окраску при реакциях с риванолом (лактатом 2-этокси-6,9-диаминоакридина) в 1,8М НСl. Соответствие с законом Бера наблюдается при 515 нм для диапазона концентраций 0,2-1,2 мкг/мл NO2-. Не мешают ионы NO3-, BO33-. Реакция с тиомочевиной. При реакции азотистой кислоты с тиомочевиной образуется роданистоводородная кислота, которая при взаимодействии с введенным Fe(III) дает окрашенный к комплекс. Метод применяют для определения 2-12 мкг/мл NO2-. Хотя этот метод менее чувствителен, чем классический метод Грисса с сульфаниловой кислотой, но простота методики является его преимуществом. Реакция с 2,3-диаминонафталином. Этот реагент использован для спектрофотометрического и флуориметрического определения нитрит-иона. Определению мешают Sn(II), Se, Al, Bi, Cr(III), Ca, Ni, Fe. Ионы NH4+, NO3- не мешают. Чувствительность спектрофотометрического определения равна 1 мкг\мл, флуориметрического - 0,0065 мкг\мл. В качестве аналитических реагентов для фотометрического определения нитрит-ионов используют некоторые красители, например, бриллиантовый зеленый и кристаллический фиолетовый. Этим методом определяют 5.10-5 моль/л NO2- (2.3 мг/л). Реакцию с сульфидом железа(II) используют для количественного определения нитрита. Чувствительность реакции 2,5 мкг\мл. Методики спектрофотометрического определения нитрит-ионов имеют хорошие метрологические характеристики, однако для анализа окрашенных и мутных растворов требуется трудоёмкая пробоподготовка. Кроме того, реагенты, используемые для проведения реакций диазотирования и азосочетания, часто нестабильны (сульфаниловая кислота) и канцерогенны (1-нафтиламин, N,N-диметиланилин).
1.1.6 Кинетические методы определения нитрит-ионов
Кинетический метод основан на окислении комплексоната марганца(II) до комплексоната марганца(III) посредством H2O2, катализируемом нитритом. Метод позволяет определить 1.10-5 г/л NO2- с ошибкой +10% и 3.10-7 г/л с ошибкой +20%. [1, с. 114]
0 комментариев