Навигация
2. Методическая часть
2.1 Получение и очистка исходных веществ
В работе был использован поливинилпирролидон с молекулярной массой- марки ч.д.а., использовался без дополнительной очистки.
![]() [ - CH2 – CH – ]
[ - CH2 – CH – ]
![]()
![]()
![]()
![]()
![]()
![]()
![]() N O
N O
Железо (ΙΙ) сернокислое 7-водное FeSO4*7H2O, чистое, использовалось после высушивания при 120°С.
Кобальта (ΙΙ) нитрит 6-водный Co(NO2)2*6H2O, чистый, использовался после высушивания при 100°С.
Кадмия (ΙΙ) хлорид CdCl2, марки ч.д.а., использовался без дополнительной очистки.
Пероксид водорода Н2О2-37% (продажный).
Соляная кислота – HCl, 1н., стандартизированная NaOH.
Растворитель – вода бидистиллированная Н2О, спирт этиловый С2Н5ОН, ρ=0,875 г/мл.
Оборудование: иономер универсальный ЭВ-74 со стеклянным и хлорсеребряным электродами, химические стаканы на 50мл., бюретки, пипетки, шкаф сушильный, весы технохимические ВГУ-1, весы аналитические ВЛР-2, мерные колбы на 50мл., вискозиметр Убеллоде, термостат, бюкс, секундомер, прибор для определения каталазной активности(изображен на рисунке №17 в приложении).
2.2 Методика проведенных экспериментов
Изучение процесса комплексообразования проводилось методом рН-метрического титрования. Оно проводилось при помощи иономера с точностью измерения ±0,05 ед. рН со стеклянным и хлорсеребряным электродами при температуре 25°С. В стакан для титрования наливали сначала 10мл. 0,1н. раствора ПВПД, затем титровали 1н. раствором HCl при постоянном перемешивании из пипетки. Измерение рН проводили через каждые 0,1мл. прилитых эквивалентов кислоты. Далее таким же образом титровали смесь 5мл. 0,1н. раствора CdCl2 и 5мл. 0,1н. раствора ПВПД, а также смесь 5мл. 0,1н. раствора Co(NO2)2 и 5мл. 0,1н. раствора ПВПД, и смесь 5мл. 0,1н. раствора FeSO4 и 5мл. 0,1н. раствора ПВПД. Вязкость исследуемых растворов (вышеперечисленных смесей полимера и солей) измерялась в капиллярном вискозиметре Убеллоде, в термостатируемой камере при 25 + 0,10С. Удельную вязкость раствора вычисляли по формуле:
ηуд.= (τ – τ0)/τ0.
Приведенную вязкость рассчитывали по формуле:
ηпр.= ηуд /С,
где С - концентрация полимера (г./дл..), τ- время истечения раствора, τ0- время истечения чистого растворителя, измеренное и равное 248сек. Вискозиметр представляет собой капиллярную трубку, соединенную с измерительным шариком. Вискозиметр погружен в термостат. Раствор засасывается грушей из резервуара вискозиметра в шарик выше верхней метки над измерительным шариком. Измеряется время истечения жидкости между верхней и нижней метками измерительного шарика. Вязкость каждого раствора измеряется 3 раза. Определяется время истечения раствора полимера (t) после каждого разбавления.
Определение каталазной активности полученных катализаторов проводилось на основе реакции разложения перекиси водорода Н2О2. Суть определения заключается в следующем. В колбу поместить дистиллированную воду объемом 1,2 мл, затем добавить 10мл. катализатора, поставить на плитку (колба находится на водяной бане) и включить магнитную мешалку. Термометром измеряется температура воды водяной бани. Как только температура начинает приближаться к 400 С, в колбу с катализатором добавить 0,9 мл Н2О2, и сразу же закрыть колбу пробкой с трубкой, соединенной с газовой бюреткой. Включить секундомер, и через определенный промежуток времени измерить объем выделяющегося кислорода. После того, как кислород перестал выделяться, установка отключалась, а катализатор оставляли на сутки для проверки стабильности. Через сутки опять добавляли 0,9мл Н2О2 и точно также измеряли объем выделяющего кислорода.
3. Практическая часть
3.1 Результаты и обсуждения
Цель работы:
1) Исследование комплексообразования ионов железа, кобальта и кадмия с поливинилпирролидоном различными физико-химическими методами;
2) Изучение влияния температуры на поведение полученных полимер-металлических комплексов;
3) Изучение влияния состава растворителя на поведение полученных полимер-металлических комплексов;
4) Изучение каталазной активности полученных полимер металлических комплексов.
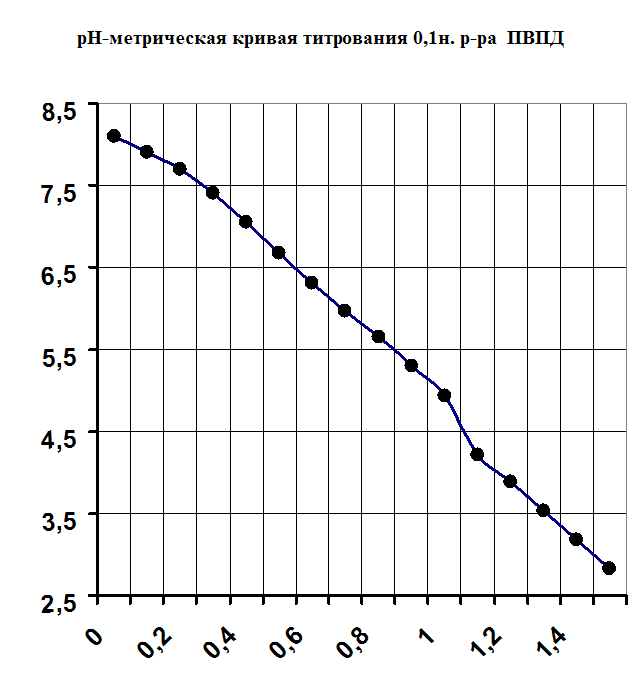
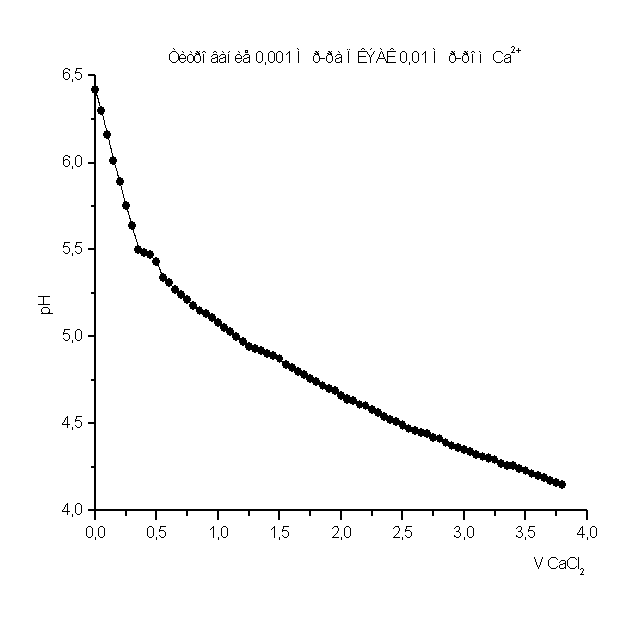
При изучении процесса комплексообразования мною был использован метод рН-метрического титрования образовавшегося полимерметаллического комплекса в мольном соотношении [металл] - [лиганд]=1:1.Также было проведено рН-метрическое титрование чистого полимера. В обоих случаях титрование проводилось 1н. раствором HCl, так как ПВПД является полиоснованием. Кривые рН-метрического титрования изображены в виде графика, где по оси абцисс откладывались значения эквивалентов прилитой кислоты, а на оси ординат откладывались значения рН. График рН-метрического титрования 1н. соляной кислотой чистого 0,1н. раствора поливинилпирролидона представлен в приложении на рисунке №1. Плавно убывающая кривая означает течение реакции нейтрализации, и постепенное накопление протонов в растворе, что и объясняет постепенное снижение рН. Кривая рН-метрического титрования 1н. соляной кислотой смеси, состоящей из 5мл. 0,1н. раствора ПВПД и 5мл. 0,1н. раствора CdCl2 также представлена в приложении на рисунке №2, в сравнении с кривыми титрования смесей 5мл. 0,1н. раствора Co(NO2)2 и 5мл. 0,1н. раствора ПВПД, и смеси 5мл. 0,1н. раствора FeSO4 и 5мл. 0,1н. раствора ПВПД. В самом начале кривая титрования для ионов Cd2+ и Co2+ в смеси с полимером имеет резкий скачок при рН от 6,3 до 3,2 и от 4,1 до 2,5 соответственно. Это позволяет с уверенностью сказать об образовании мономолекулярного комплекса. Титрование в этом случае было проведено три раза и было выведено среднее арифметическое значение рН (смотрите таблицу в приложении). Однако, при титровании смеси соли железа (II) с полимером не наблюдалось скачков рН при титровании. Это указывает на то, что металлполимерный комплекс не образовался, как в предыдущих случаях.
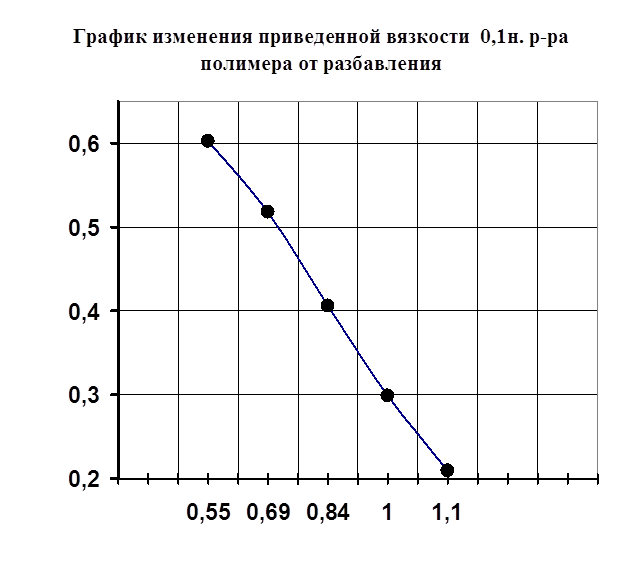
Одним из специфических методов исследования полимеров является метод вискозиметрии в разбавленных растворах полимеров. Он позволяет наблюдать изменение вязкости полимера в присутствии различного вида растворителей, а также солей металлов. Таким образом, мной было исследование изменения вязкости полимера в присутствии растворителя-воды и изменение вязкости при добавлении к раствору полимера порций солей металла (FeSO4, Co(NO2)2, CdCl2). Предположительно, взаимодействие полимера с металлом осуществляется через карбонильный кислород полимера. Также мной изучено действие растворителя и температуры на устойчивость полимерных комплексов. На рисунке №3 показано изменение приведенной вязкости (ось ординат) от разбавления (ось абцисс) в отсутствии ионов металла. Из графика виден рост приведенной вязкости, что объясняется силами электростатического взаимодействия между одинаково заряженными звеньями макромолекулы, а также молекулами воды. На рисунке №4 изображена кривая приведенной вязкости ПВПД в присутствии ионов металлов Fe2+, Cd2+, Cо2+ . Ранее методом потенциометрического титрования было доказано отсутствие комплексообразования в системе ПВПД-Fe2+, однако, мною был проведен подтверждающий эксперимент методом вискозиметрии. На рисунке видно, что высокое значение приведенной вязкости чистого раствора полимера при разбавлении солью металла резко снижается, что можно объяснить связыванием ионов металла с макромолекулами полимера, что, в свою очередь, приводит к уменьшению гидродинамических свойств последних. Такое изменение приведенной вязкости чистого полимера характерно для разбавления его солями Co2+, Cd2+. Однако при разбавлении ионами железа наблюдается сильное повышение приведенной вязкости. Это указывает на отсутствие взаимодействия ионов железа с полимером, а приведенная вязкость возрастает из-за сил электростатического взаимодействия звеньев полимера с молекулами растворителя. Таким образом, мною было доказано двумя различными по исполнению методами отсутствие взаимодействия ионов железа (II) с ПВПД и образование комплексов ПВПД-Cd2+ и ПВПД-Co2+.
Далее мною была исследована прочность полученных металлполимерных комплексов. Изучалось влияние на прочность температуры и состава растворителя.
На рисунке №5 представлены кривые приведенной вязкости комплексов ПВПД-Cd2+ и ПВПД-Co2+ в зависимости от состава растворителя Н2О:С2Н5ОН. Кривая 1 (ПВПД-Co2+) отображает поведение данного комплекса от состава растворителя. Как видно из рисунка, наблюдается увеличение приведенной вязкости (от 0,1 до 0,37) с увеличением объемных процентов этилового спирта, что свидетельствует о раскручивании полимерного клубка. Кривая 2 (ПВПД-Cd2+) отображает приведенную вязкость данного комплекса по сравнению с вязкостью комплекса ПВПД-Co2+. Как видно из кривой, вязкость комплекса имеет низкие значения (от 0,13 до 0,19) вне зависимости от состава растворителя, что указывает на его высокую прочность и устойчивость к растворению органическими растворителями.
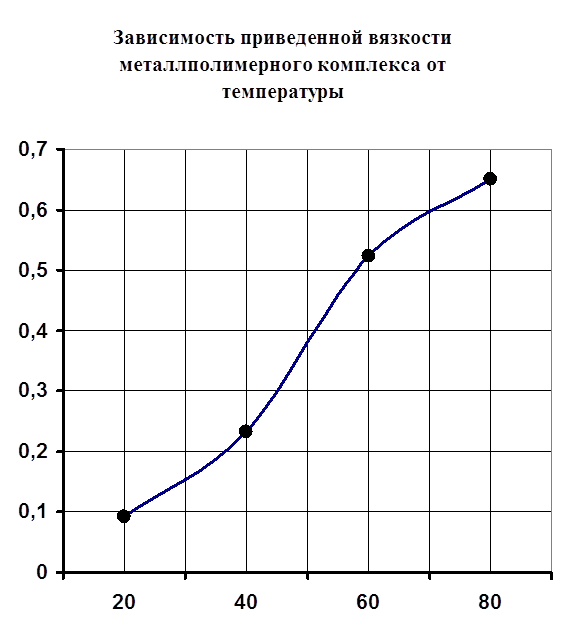
Также было проведено изучение изменения вязкости образовавшегося комплекса от температуры. Нужно отметить, что все предыдущие исследования по изменению вязкости проводились при постоянной температуре 25 °C. В данном же случае проведены исследования при 25, 40, 60°С. Как видно из построенного графика (рисунок №6) наблюдается рост приведенной вязкости с повышением температуры в обоих случаях. В перспективе же возможно выпадение осадка или же переход раствора в состояние геля. Именно поэтому при более высоких температурах измерение вязкости металлполимерных комплексов не рекомендуется, так как возможно засорение капилляра вискозиметра.
Далее мною проводились эксперименты по изучению каталазной активности полученных металлполимерных комплексов. Проверялась их ускоряющая способность реакции разложения пероксида водорода. Использовались соотношения металл: лиганд=1:1, 1:2, 2:1, 1:4, 1:6. Данные соотношения были выбраны, исходя из координационных чисел иона-комплексообразователя (у Cd и Co координационные числа могут быть 2, 4, 6). Судя по полученным данным, мы можем сказать, что использование растворов полученных металлполимерных комплексов в качестве катализаторов обоснованно, так как они ускоряют данную химическую реакцию, но нецелесообразно, так как ускорение реакции минимально. Самой высокой каталазной активностью обладают комплексы кадмия в соотношении металл: лиганд=1:1 и 1:4. Комплексы кобальта же проявляют самую малую каталазную активность. Однако, если рассматривать графики №13,14,16 то можно выявить постепенное (и достаточно интенсивное для данного случая) увеличение степени разложения пероксида водорода по времени, что указывает на стабильность полученного катализатора.
Выводы
1. Методами рН-метрического титрования и вискозиметрии обнаружено и доказано комплексообразование в системе поливинилпирролидон-Cd2+ и Co2+. Обнаружено, что поливинилпирролидон не образует комплексы с железом (II) в данных условиях.
2. Изучено влияние температуры на стабильность образовавшихся комплексов. Было выяснено, что повышение температуры ведет к повышению приведенной вязкости, что свидетельствует о деструкционных процессах полимер-металлических комплексов.
3. Изучено влияние состава растворителя на стабильность металлполимерных комплексов. Обнаружено, что комплекс ПВПД- Cd2+ почти не изменяет приведенной вязкости с увеличением объемных процентов спирта этилового С2Н5ОН, что указывает на его прочность к действию органических растворителей. С другой стороны, комплекс ПВПД-Со2+ сохраняет свои характеристики только в водной среде.
4. Изучена каталазная активность полимер-металлических комплексов, и выяснено, что растворы данных комплексов обладают малой каталазной активностью. Обнаружено, что наилучшим соотношением [металл]: [лиганд] является соотношение 1:1 и 1:4.
Список литературы
1. А.А. Берлин, В.Е.Басян. «Основы адгезии полимеров», «Химия». М., 1969г.
2. Я.О.Бикерман. «Высокомолекулярные соединения», «Химия», 1968г.
3. Е.А. Бектуров, Л.А. Бимендина «Интерполимерные комплексы», «Наука Каз. ССР», А.-Ата, 1977г.
4. Е.А.Бектуров, Л.А.Бимендина, Г.К.Мамытбеков. «Комплексы водорастворимых полимеров и гидрогелей», А.-Ата, 2002г.
5. Бектуров Е.А., Бимендина Л.А., Кудайбергенов С.Е. «Полимерные комплексы и катализаторы», Алма-Ата, Наука, 1982г.
6. Л.А. Бимендина, М.Г. Яшкарова, С.Е. Кудайбергенов, Е.А. Бектуров. «Полимерные комплексы», Семипалатинск, 2003г.
7. С.С. Воюцкий. «Адгезия и аутогезия полимеров», «Ростехиздат», М., 1963г.
8. А.Г.Гавриленко, К.С.Тусупова, С.В.Тарасенко. «Оформление курсовых и дипломных работ естественно-научных специальностей», Государственный университет имени Шакарима, Семипалатинск, 2000г.
9. Зезин А.Б., Кабанов В.А. // Успехи химии. 1982.Вып.9.
10. Б.А.Киселев. «Стеклопластики», «Госхимиздат», M., 1961г.
11. В.А. Кабанов. «Физико-химические основы и перспективы применения растворимых интерполиэлектролитных комплексов», М., 1994г.
12. В.А. Кабанов, А.Б. Зезин. «Водорастворимые нестехиометричные полиэлектролитные комплексы – новый класс синтетических полиэлектролитов», Сер. «Органическая химия». М., 1984г.
13. Кабанов Н.М., Кокорин А.И., Рогачева В.Б., Зезин А.Б. «Высокомолекулярные соединения»,1979. Т.А21.
14. Кабанов Н.М.Кожевникова Н.А., Кокорин А.И., Рогачева В.Б., Зезин А.Б., кабанов В.А. // Высокомол.соед.1979.Т.А21.
15. Кабанов Н.М., Хван А.М., Рогачева В.Б., зезеин А.Б., Кабанов В.А. // Высокомол.соед.1979.Т.Б21.
16. Н. А.Кротова. «О склеивании и прилипании», Изд-во АН СССР. М., 1960г.
17. Пирсон Р.Дж. Жесткие и мягкие кислоты и основания. //Успехи химии. 1971. Т.40.
18. Усанович М.И. «Исследования в области теории растворов и теории кислот и оснований». Алматы. «Наука». 1970.
19. И.К.Цитович. «Курс аналитической химии», М., «Высшая школа», 1985г.
20. Nsuchida E., Abe K.// Adv. Polym.Sci/ 1982. V.45.P.1
21. Saegusa T., Kobayashi S., Yfeashi K., Yamada A. //Polym.J. 1978. V.10
22. Guilbaut L.J., Murano M., Harnwood H.J. // J.Macromol. Sci.Chem. 1973. V.7. 23. Nishide H., Tsuchida E. // Macromol.Chem. 1976. B. 177.S.2453
24. Nishide H., Tsuchida E. // Macromol.Chem. 1976. B. 177.S.2295
25. Utkelov B.F., Ergozhin E.E. // Macromok.Chem.Macromol.Sump.1989. V.26.
26. Utkelov B.A., Nurachmetov K.N., Ergozhin E.E. //Macromok.Chem.Rapid Commun. 1990. V.11.P.1
27. Davankov V.A., Semechkin A.V. // J.Chromatogr. 1977. V.41.P.313
28.Trochimczuk A.W. // MMC-7, 7-th Intern.Symp.Macromolecule-Metal Complexes.Leiden.The Netherlands. 1997.
Приложение
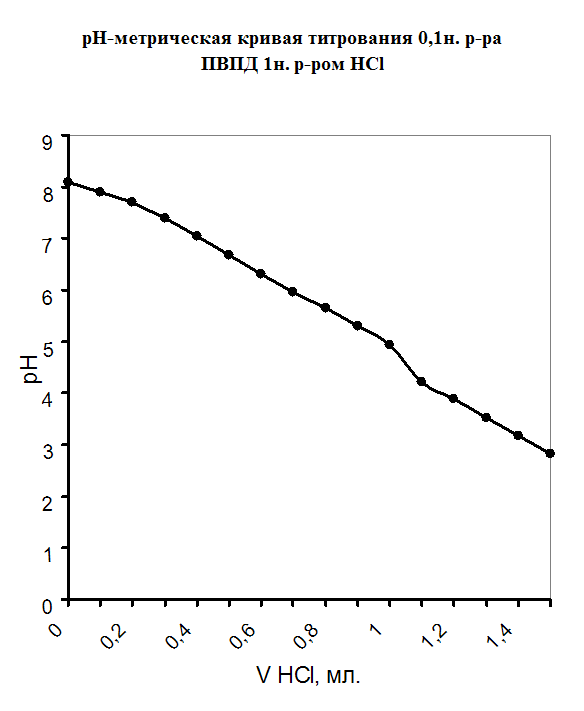
Рисунок №1.
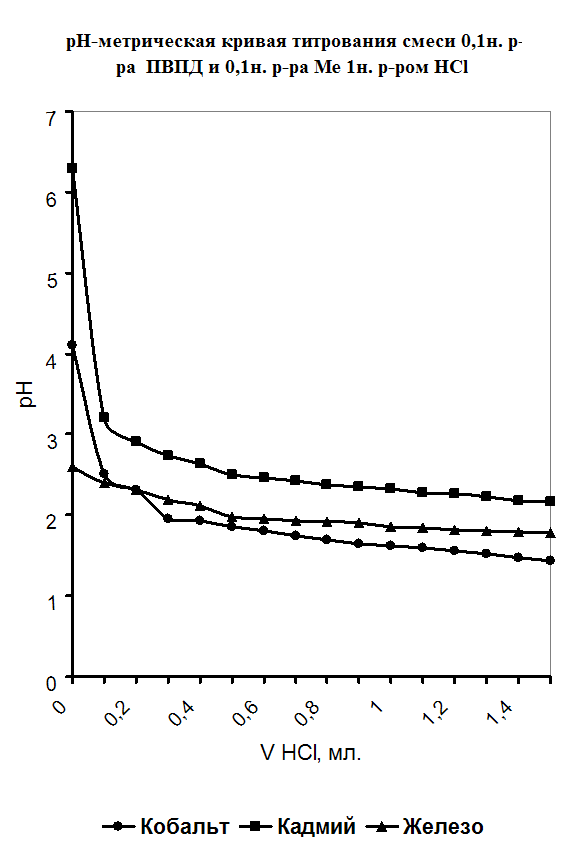
Рисунок №2
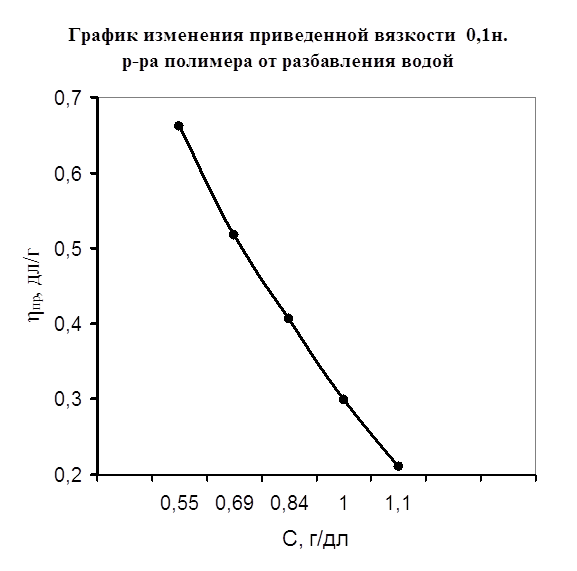
Рисунок №3.
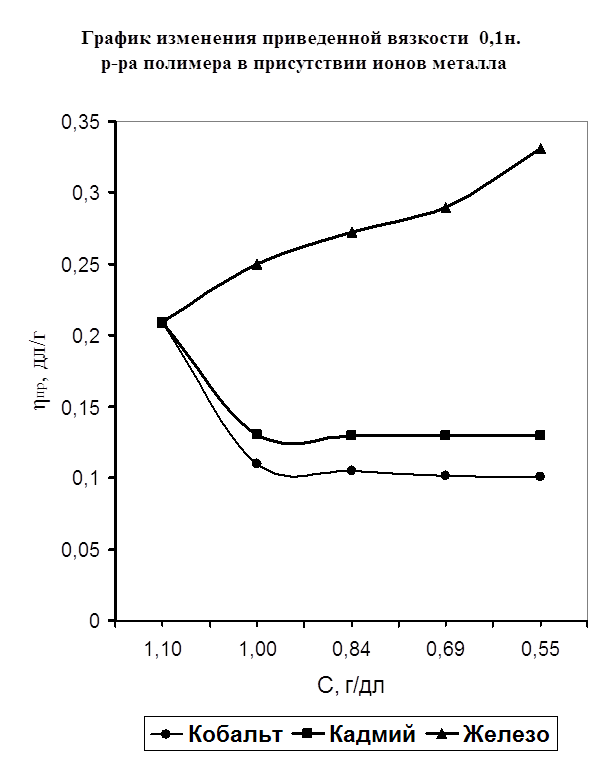
Рисунок №4.
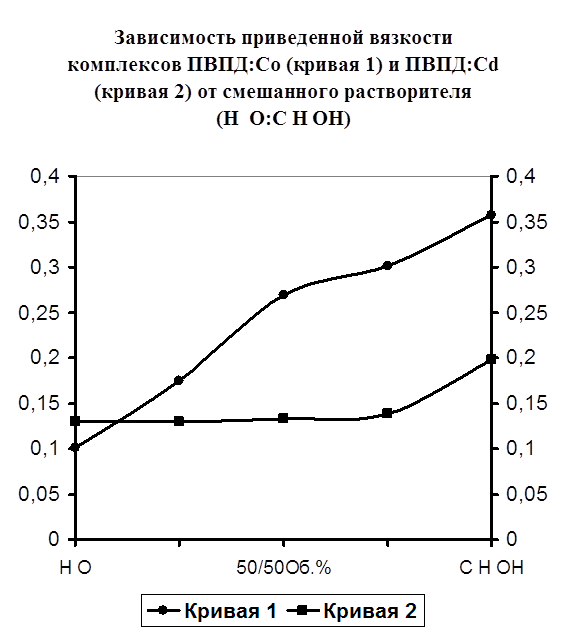
Рисунок №5
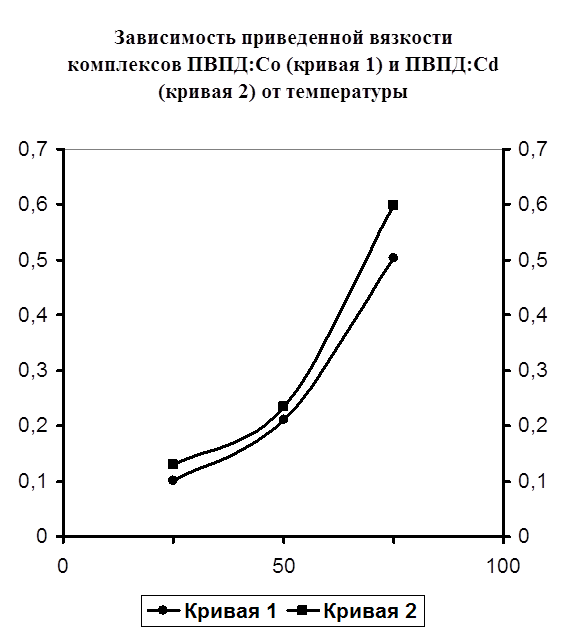
Рисунок №6
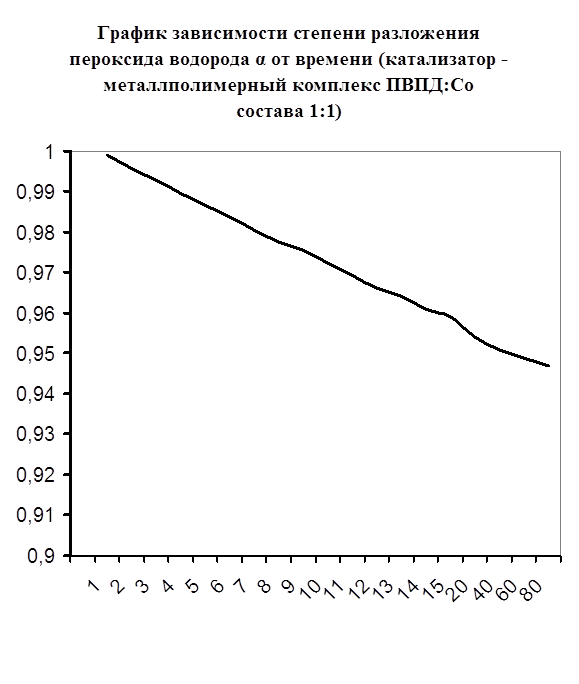 Рисунок №7.
Рисунок №7.
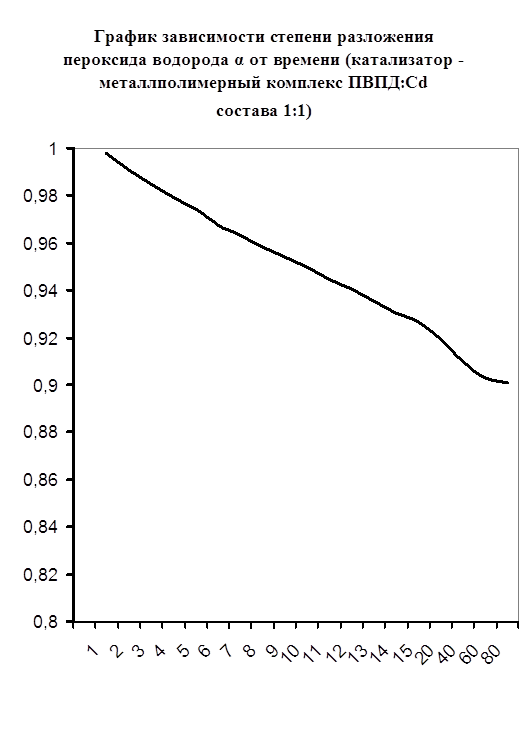
Рисунок №8.
 Рисунок №9.
Рисунок №9.
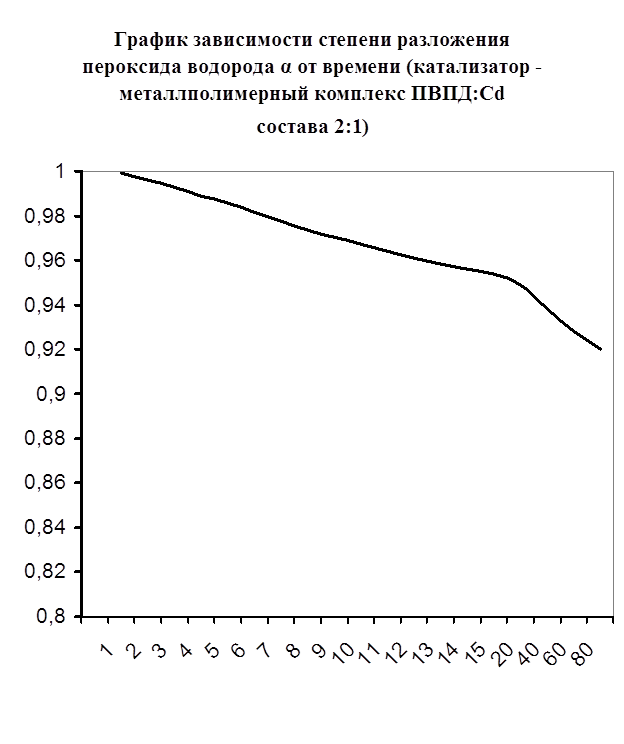 Рисунок №10.
Рисунок №10.
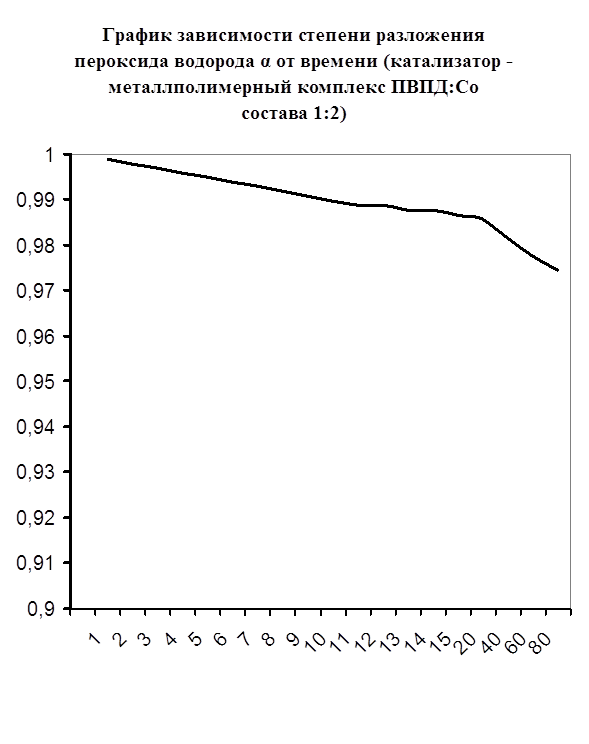 Рисунок №11
Рисунок №11
 Рисунок №12.
Рисунок №12.
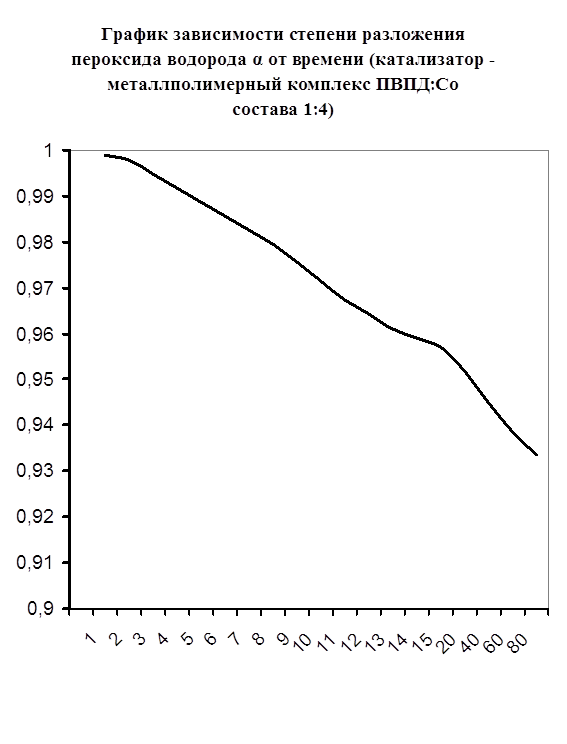 Рисунок №13.
Рисунок №13.
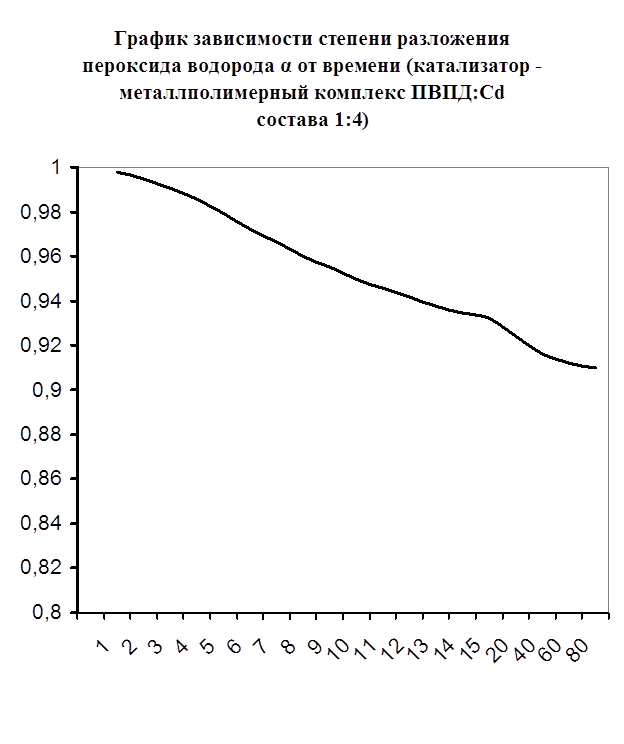 Рисунок №14.
Рисунок №14.
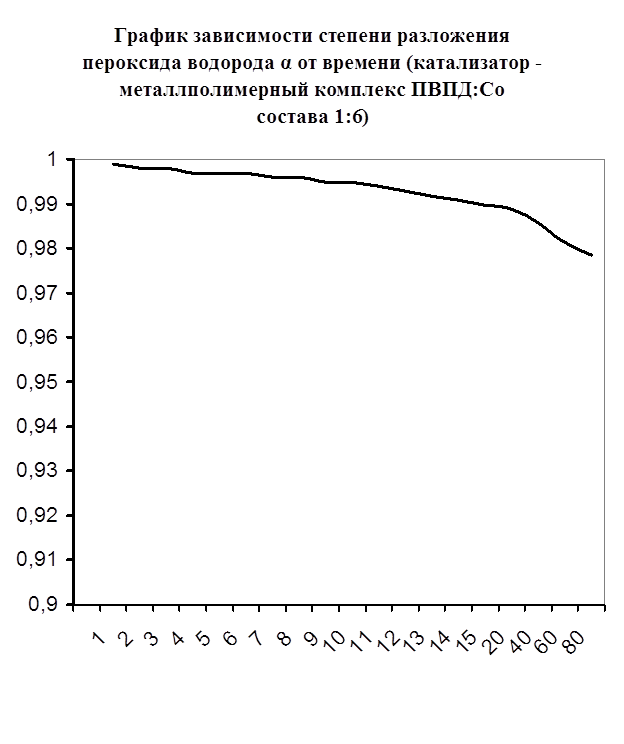 Рисунок №15.
Рисунок №15.
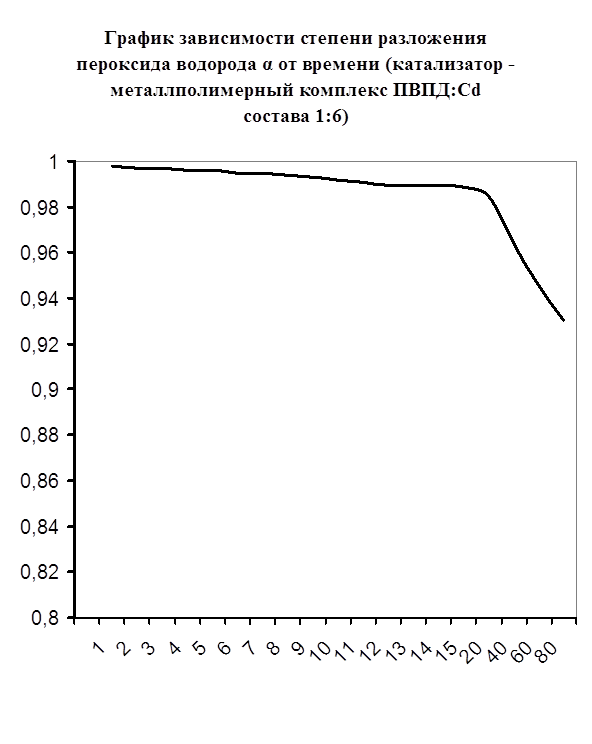 Рисунок №16
Рисунок №16

Рисунок №17
Результаты потенциометрического титрования 0,1н. р-ра ПВПД 1н. р-ром HCl
| Количество прилитого 1н. HCl, мл. | Значения рН первого титрования | Значения рН второго титрования | Значения рН третьего титрования | Среднее значение рН |
| 0 | 8,1 | 8,1 | 8,1 | 8,1 |
| 0,1 | 7,8 | 7,7 | 7,9 | 7,9 |
| 0,2 | 7,75 | 7,65 | 7,7 | 7,7 |
| 0,3 | 7,42 | 7,38 | 7,41 | 7,4 |
| 0,4 | 7,05 | 7,05 | 7,03 | 7,05 |
| 0,5 | 6,75 | 6,67 | 6,65 | 6,67 |
| 0,6 | 6,31 | 6,31 | 6,3 | 6,31 |
| 0,7 | 6,0 | 5,8 | 6,0 | 5,97 |
| 0,8 | 5,62 | 5,66 | 5,65 | 5,65 |
| 0,9 | 5,3 | 5,31 | 5,3 | 5,3 |
| 1,0 | 4,9 | 4,96 | 4,92 | 4,93 |
| 1,1 | 4,22 | 4,22 | 4,21 | 4,22 |
| 1,2 | 3,87 | 3,88 | 3,9 | 3,89 |
| 1,3 | 3,52 | 3,54 | 3,53 | 3,53 |
| 1,4 | 3,22 | 3,15 | 3,18 | 3,18 |
| 1,5 | 2,8 | 2,8 | 2,82 | 2,8 |
Результаты потенциометрического титрования системы ПВПД Co2+(1:1) 1н. р-ром HCl
| Количество прилитого 1н. HCl, мл. | Значения рН первого титрования | Значения рН второго титрования | Значения рН третьего титрования | Среднее значение рН |
| 0 | 4,1 | 4,1 | 4,1 | 4,1 |
| 0,1 | 2,5 | 2,45 | 2,58 | 2,51 |
| 0,2 | 2,3 | 2,38 | 2,25 | 2,31 |
| 0,3 | 2,0 | 1,9 | 1,94 | 1,95 |
| 0,4 | 1,92 | 1,95 | 1,93 | 1,93 |
| 0,5 | 1,86 | 1,84 | 1,86 | 1,85 |
| 0,6 | 1,81 | 1,8 | 1,8 | 1,8 |
| 0,7 | 1,75 | 1,74 | 1,72 | 1,74 |
| 0,8 | 1,7 | 1,7 | 1,69 | 1,7 |
| 0,9 | 1,65 | 1,64 | 1,63 | 1,64 |
| 1,0 | 1,63 | 1,62 | 1,62 | 1,62 |
| 1,1 | 1,6 | 1,59 | 1,59 | 1,59 |
| 1,2 | 1,56 | 1,55 | 1,57 | 1,56 |
| 1,3 | 1,51 | 1,51 | 1,53 | 1,516 |
| 1,4 | 1,47 | 1,46 | 1,47 | 1,47 |
| 1,5 | 1,42 | 1,43 | 1,45 | 1,43 |
Результаты потенциометрического титрования системы ПВПД Cd2+(1:1) 1н. р-ром HCl
| Количество прилитого 1н. HCl, мл. | Значения рН первого титрования | Значения рН второго титрования | Значения рН третьего титрования | Среднее значение рН |
| 0 | 6,3 | 6,3 | 6,3 | 6,3 |
| 0,1 | 3,2 | 3,22 | 3,19 | 3,2 |
| 0,2 | 2,9 | 2,95 | 2,89 | 2,91 |
| 0,3 | 2,7 | 2,73 | 2,75 | 2,73 |
| 0,4 | 2,6 | 2,66 | 2,62 | 2,63 |
| 0,5 | 2,5 | 2,51 | 2,5 | 2,5 |
| 0,6 | 2,46 | 2,45 | 2,46 | 2,46 |
| 0,7 | 2,42 | 2,4 | 2,43 | 2,42 |
| 0,8 | 2,38 | 2,36 | 2,37 | 2,37 |
| 0,9 | 2,35 | 2,34 | 2,35 | 2,35 |
| 1,0 | 2,33 | 2,33 | 2,32 | 2,33 |
| 1,1 | 2,29 | 2,28 | 2,28 | 2,28 |
| 1,2 | 2,26 | 2,25 | 2,27 | 2,26 |
| 1,3 | 2,22 | 2,23 | 2,21 | 2,22 |
| 1,4 | 2,18 | 2,18 | 2,19 | 2,18 |
| 1,5 | 2,16 | 2,15 | 2,16 | 2,16 |
Результаты потенциометрического титрования системы ПВПД- e2+(1:1) 1н. р-ром HCl.
| Количество прилитого 1н. HCl, мл. | Значения рН первого титрования | Значения рН второго титрования | Значения рН третьего титрования | Среднее значение рН |
| 0 | 2,6 | 2,6 | 2,6 | 2,6 |
| 0,1 | 2,4 | 2,4 | 2,41 | 2,4 |
| 0,2 | 2,3 | 2,31 | 2,31 | 2,31 |
| 0,3 | 2,2 | 2,19 | 2,19 | 2,19 |
| 0,4 | 2,1 | 2,1 | 2,12 | 2,11 |
| 0,5 | 1,98 | 1,98 | 1,97 | 1,98 |
| 0,6 | 1,96 | 1,95 | 1,97 | 1,96 |
| 0,7 | 1,94 | 1,93 | 1,93 | 1,93 |
| 0,8 | 1,92 | 1,92 | 1,93 | 1,92 |
| 0,9 | 1,9 | 1,9 | 1,91 | 1,9 |
| 1,0 | 1,86 | 1,85 | 1,86 | 1,86 |
| 1,1 | 1,84 | 1,84 | 1,85 | 1,84 |
| 1,2 | 1,82 | 1,82 | 1,83 | 1,82 |
| 1,3 | 1,8 | 1,8 | 1,81 | 1,8 |
| 1,4 | 1,79 | 1,79 | 1,8 | 1,79 |
| 1,5 | 1,78 | 1,78 | 1,78 | 1,78 |
Концентрационная зависимость приведенной вязкости полимера (0,1н. ПВПД) от разбавления водой.
| t Vисх. 5мл | t1 (+0,5) | t2 (+1,0) | t3 (+1,5) | t4 (+2,0) | С, г/дл | hуд= t/t0-1 | hуд / С, дл/г |
| 305,0 305,0 305,0 | 322,0 322,0 322,0 | 333,1 333,0 333,0 | 336,0 336,1 336,0 | 338,1 338,1 338,1 | 1,09683 0,9971 0,84371 0,68552 0,5484 | 0,2298 0,2984 0,3427 0,3549 0,3629 | 0,2095 0,2993 0,4062 0,5176 0,6617 |
Концентрационная зависимость приведенной вязкости полимера (0,1н. ПВПД) от разбавления 0,1н. р-ром CdCl2
| t Vисх. 5мл | t1 (+0,5) | t2 (+1,0) | t3 (+1,5) | t4 (+2,0) | С, г/дл | hуд= t/t0-1 | hуд / С, дл/г |
| 305,0 305,0 305,0 | 280,2 280,2 280,1 | 275,2 275,1 275,2 | 270,0 270,0 270,0 | 265,6 265,5 265,6 | 1,09683 0,9971 0,84371 0,68552 0,5484 | 0,2298 0,1298 0,1095 0,08877 0,0708 | 0,2095 0,1302 0,1298 0,1295 0,1292 |
Концентрационная зависимость приведенной вязкости полимера (0,1н. ПВПД) от разбавления 0,1н. р-ром Co(NO2)2
| t Vисх. 5мл | t1 (+0,5) | t2 (+1,0) | t3 (+1,5) | t4 (+2,0) | С, г/дл | hуд= t/t0-1 | hуд / С, дл/г |
| 305,0 305,0 305,0 | 275,2 275,1 275,2 | 270,0 269,9 270,0 | 265,2 265,2 265,2 | 261,7 261,7 261,7 | 1,09683 0,9971 0,84371 0,68552 0,5484 | 0,2298 0,1098 0,0887 0,0694 0,0554 | 0,2095 0,1101 0,1051 0,1012 0,1010 |
Концентрационная зависимость приведенной вязкости полимера (0,1н. ПВПД) от разбавления 0,1н. р-ром FeSO4
| t Vисх. 5мл | t1 (+0,5) | t2 (+1,0) | t3 (+1,5) | t4 (+2,0) | С, г/дл | hуд= t/t0-1 | hуд / С, дл/г |
| 305,0 305,0 305,0 | 309,7 309,7 309,7 | 304,9 305,0 304,9 | 297,3 297,3 297,2 | 293,1 293,0 293,0 | 1,09683 0,9971 0,84371 0,68552 0,5484 | 0,2298 0,2489 0,2296 0,1987 0,1817 | 0,2095 0,2496 0,2721 0,2899 0,3313 |
Каталазная активность мталлполимерного комплекса ПВПД:Co2+ состава (1:1)
| t , мин. | V0 , мл | Δt | Δ V0 | Δ V0 / Δt | α |
| 1 | 0,1 | 1 | 0 | 0 | 0,9989 |
| 2 | 0,4 | 1 | 0,3 | 0,3 | 0,9959 |
| 3 | 0,7 | 1 | 0,3 | 0,3 | 0,9928 |
| 4 | 1,0 | 1 | 0,3 | 0,3 | 0,9897 |
| 5 | 1,3 | 1 | 0,3 | 0,3 | 0,9867 |
| 6 | 1,6 | 1 | 0,3 | 0,3 | 0,9836 |
| 7 | 1,9 | 1 | 0,3 | 0,3 | 0,98057 |
| 8 | 2,2 | 1 | 0,2 | 0,2 | 0,9775 |
| 9 | 2,4 | 1 | 0,3 | 0,3 | 0,97546 |
| 10 | 2,7 | 1 | 0,3 | 0,3 | 0,97239 |
| 11 | 3,0 | 1 | 0,3 | 0,3 | 0,9693 |
| 12 | 3,3 | 1 | 0,3 | 0,3 | 0,96625 |
| 13 | 3,5 | 1 | 0,2 | 0,2 | 0,9642 |
| 14 | 3,8 | 1 | 0,3 | 0,3 | 0,9611 |
| 15 | 4,0 | 1 | 0,2 | 0,2 | 0,9591 |
| 20 | 4,5 | 5 | 0,5 | 0,1 | 0,95398 |
| 40 | 4,8 | 20 | 0,3 | 0,015 | 0,95092 |
| 60 | 5,0 | 20 | 0,2 | 0,01 | 0,94887 |
| 80 | 5,2 | 20 | 0,2 | 0,01 | 0,9468 |
Каталазная активность мталлполимерного комплекса ПВПД:Cd2+ состава (1:1)
| t , мин. | V0 , мл | Δt | Δ V0 | Δ V0 / Δt | α |
| 1 | 0,2 | 1 | 0 | 0 | 0,9979 |
| 2 | 0,9 | 1 | 0,6 | 0,6 | 0,9908 |
| 3 | 1,5 | 1 | 0,5 | 0,5 | 0,9846 |
| 4 | 2,0 | 1 | 0,5 | 0,5 | 0,9795 |
| 5 | 2,5 | 1 | 0,5 | 0,5 | 0,9744 |
| 6 | 3,2 | 1 | 0,7 | 0,7 | 0,9673 |
| 7 | 3,6 | 1 | 0,4 | 0,4 | 0,9632 |
| 8 | 4,1 | 1 | 0,5 | 0,5 | 0,9581 |
| 9 | 4,5 | 1 | 0,4 | 0,4 | 0,9540 |
| 10 | 4,9 | 1 | 0,4 | 0,4 | 0,9499 |
| 11 | 5,4 | 1 | 0,5 | 0,5 | 0,9448 |
| 12 | 5,8 | 1 | 0,4 | 0,4 | 0,9407 |
| 13 | 6,3 | 1 | 0,5 | 0,5 | 0,9356 |
| 14 | 6,8 | 1 | 0,5 | 0,5 | 0,9305 |
| 15 | 7,2 | 1 | 0,4 | 0,4 | 0,9264 |
| 20 | 7,9 | 5 | 0,7 | 0,14 | 0,9192 |
| 40 | 8,8 | 20 | 0,9 | 0,045 | 0,91 |
| 60 | 9,5 | 20 | 0,7 | 0,035 | 0,9028 |
| 80 | 9,7 | 20 | 0,2 | 0,01 | 0,9008 |
Каталазная активность мталлполимерного комплекса ПВПД:Cо2+ состава (2:1)
| t , мин. | V0 , мл | Δt | Δ V0 | Δ V0 / Δt | α |
| 1 | 0,1 | 1 | 0 | 0 | 0,9989 |
| 2 | 0,1 | 1 | 0 | 0 | 0,9989 |
| 3 | 0,2 | 1 | 0,1 | 0,1 | 0,9979 |
| 4 | 0,2 | 1 | 0 | 0 | 0,9979 |
| 5 | 0,3 | 1 | 0,1 | 0,1 | 0,9969 |
| 6 | 0,4 | 1 | 0,1 | 0,1 | 0,9959 |
| 7 | 0,5 | 1 | 0,1 | 0,1 | 0,9948 |
| 8 | 0,5 | 1 | 0 | 0 | 0,9948 |
| 9 | 0,6 | 1 | 0,1 | 0,1 | 0,9938 |
| 10 | 0,7 | 1 | 0,1 | 0,1 | 0,9928 |
| 11 | 0,8 | 1 | 0,1 | 0,1 | 0,9918 |
| 12 | 1,0 | 1 | 0,2 | 0,2 | 0,9897 |
| 13 | 1,1 | 1 | 0,1 | 0,1 | 0,9887 |
| 14 | 1,1 | 1 | 0 | 0 | 0,9887 |
| 15 | 1,1 | 1 | 0 | 0 | 0,9887 |
| 20 | 1,2 | 5 | 0,1 | 0,02 | 0,9877 |
| 40 | 1,3 | 20 | 0,1 | 0,005 | 0,9867 |
| 60 | 1,3 | 20 | 0 | 0 | 0,9867 |
| 80 | 1,3 | 20 | 0 | 0 | 0,9867 |
Каталазная активность мталлполимерного комплекса ПВПД:Cd2+ состава (2:1)
| t , мин. | V0 , мл | Δt | Δ V0 | Δ V0 / Δt | α |
| 1 | 0,1 | 1 | 0 | 0 | 0,9989 |
| 2 | 0,4 | 1 | 0,3 | 0,3 | 0,9959 |
| 3 | 0,7 | 1 | 0,3 | 0,3 | 0,9928 |
| 4 | 1,1 | 1 | 0,4 | 0,4 | 0,9887 |
| 5 | 1,4 | 1 | 0,3 | 0,3 | 0,9856 |
| 6 | 1,8 | 1 | 0,4 | 0,4 | 0,9816 |
| 7 | 2,2 | 1 | 0,4 | 0,4 | 0,9775 |
| 8 | 2,6 | 1 | 0,4 | 0,4 | 0,9734 |
| 9 | 2,9 | 1 | 0,3 | 0,3 | 0,9703 |
| 10 | 3,2 | 1 | 0,3 | 0,3 | 0,9673 |
| 11 | 3,5 | 1 | 0,3 | 0,3 | 0,9642 |
| 12 | 3,8 | 1 | 0,3 | 0,3 | 0,9611 |
| 13 | 4,1 | 1 | 0,3 | 0,3 | 0,9581 |
| 14 | 4,3 | 1 | 0,2 | 0,2 | 0,956 |
| 15 | 4,5 | 1 | 0,2 | 0,2 | 0,9539 |
| 20 | 5,0 | 5 | 0,5 | 0,1 | 0,9488 |
| 40 | 6,0 | 20 | 1,0 | 0,05 | 0,9386 |
| 60 | 7,0 | 20 | 1,0 | 0,05 | 0,9284 |
| 80 | 7,8 | 20 | 0,8 | 0,04 | 0,9202 |
Каталазная активность мталлполимерного комплекса ПВПД:Cо2+ состава (1:2)
| t , мин. | V0 , мл | Δt | Δ V0 | Δ V0 / Δt | α |
| 1 | 0,1 | 1 | 0 | 0 | 0,9989 |
| 2 | 0,2 | 1 | 0,1 | 0,1 | 0,9979 |
| 3 | 0,3 | 1 | 0,1 | 0,1 | 0,9969 |
| 4 | 0,4 | 1 | 0,1 | 0,1 | 0,9959 |
| 5 | 0,5 | 1 | 0,1 | 0,1 | 0,9949 |
| 6 | 0,6 | 1 | 0,1 | 0,1 | 0,9939 |
| 7 | 0,7 | 1 | 0,1 | 0,1 | 0,9929 |
| 8 | 0,8 | 1 | 0,1 | 0,1 | 0,9919 |
| 9 | 0,9 | 1 | 0,1 | 0,1 | 0,9908 |
| 10 | 1,0 | 1 | 0,1 | 0,1 | 0,9897 |
| 11 | 1,1 | 1 | 0,1 | 0,1 | 0,9887 |
| 12 | 1,1 | 1 | 0 | 0 | 0,9887 |
| 13 | 1,2 | 1 | 0,1 | 0,1 | 0,9877 |
| 14 | 1,2 | 1 | 0 | 0 | 0,9877 |
| 15 | 1,3 | 1 | 0,1 | 0,1 | 0,9867 |
| 20 | 1,4 | 5 | 0,1 | 0,02 | 0,9857 |
| 40 | 1,8 | 20 | 0,4 | 0,02 | 0,9815 |
| 60 | 2,2 | 20 | 0,4 | 0,02 | 0,9775 |
| 80 | 2,5 | 20 | 0,3 | 0,015 | 0,9744 |
Каталазная активность мталлполимерного комплекса ПВПД:Cd2+ состава (1:2)
| t , мин. | V0 , мл | Δt | Δ V0 | Δ V0 / Δt | α |
| 1 | 0,1 | 1 | 0 | 0 | 0,9989 |
| 2 | 0,3 | 1 | 0,2 | 0,2 | 0,9969 |
| 3 | 0,7 | 1 | 0,4 | 0,4 | 0,9928 |
| 4 | 1,2 | 1 | 0,5 | 0,5 | 0,9877 |
| 5 | 1,7 | 1 | 0,5 | 0,5 | 0,9826 |
| 6 | 2,3 | 1 | 0,6 | 0,6 | 0,9765 |
| 7 | 2,8 | 1 | 0,5 | 0,5 | 0,9714 |
| 8 | 3,3 | 1 | 0,5 | 0,5 | 0,9662 |
| 9 | 3,8 | 1 | 0,5 | 0,5 | 0,9611 |
| 10 | 4,3 | 1 | 0,5 | 0,5 | 0,956 |
| 11 | 4,7 | 1 | 0,4 | 0,4 | 0,9519 |
| 12 | 5,0 | 1 | 0,3 | 0,3 | 0,9488 |
| 13 | 5,3 | 1 | 0,3 | 0,3 | 0,9458 |
| 14 | 5,6 | 1 | 0,3 | 0,3 | 0,9427 |
| 15 | 5,9 | 1 | 0,3 | 0,3 | 0,9397 |
| 20 | 6,4 | 5 | 0,5 | 0,1 | 0,9345 |
| 40 | 6,8 | 20 | 0,4 | 0,02 | 0,9305 |
| 60 | 7,2 | 20 | 0,4 | 0,02 | 0,9263 |
| 80 | 7,5 | 20 | 0,3 | 0,015 | 0,9233 |
Каталазная активность мталлполимерного комплекса ПВПД:Cо2+ состава (1:4)
| t , мин. | V0 , мл | Δt | Δ V0 | Δ V0 / Δt | α |
| 1 | 0,1 | 1 | 0 | 0 | 0,9989 |
| 2 | 0,2 | 1 | 0,1 | 0,1 | 0,9979 |
| 3 | 0,5 | 1 | 0,3 | 0,3 | 0,9948 |
| 4 | 0,8 | 1 | 0,3 | 0,3 | 0,9918 |
| 5 | 1,1 | 1 | 0,3 | 0,3 | 0,9887 |
| 6 | 1,4 | 1 | 0,3 | 0,3 | 0,9857 |
| 7 | 1,7 | 1 | 0,3 | 0,3 | 0,9826 |
| 8 | 2,0 | 1 | 0,3 | 0,3 | 0,9795 |
| 9 | 2,4 | 1 | 0,4 | 0,4 | 0,9755 |
| 10 | 2,8 | 1 | 0,4 | 0,4 | 0,9714 |
| 11 | 3,2 | 1 | 0,4 | 0,4 | 0,9673 |
| 12 | 3,5 | 1 | 0,3 | 0,3 | 0,9642 |
| 13 | 3,8 | 1 | 0,3 | 0,3 | 0,9611 |
| 14 | 4,0 | 1 | 0,2 | 0,2 | 0,9591 |
| 15 | 4,2 | 1 | 0,2 | 0,2 | 0,957 |
| 20 | 4,7 | 5 | 0,5 | 0,1 | 0,9519 |
| 40 | 5,4 | 20 | 0,7 | 0,035 | 0,9448 |
| 60 | 6,0 | 20 | 0,4 | 0,02 | 0,9386 |
| 80 | 6,5 | 20 | 0,5 | 0,025 | 0,9335 |
Каталазная активность мталлполимерного комплекса ПВПД:Cd2+ состава (1:4)
| t , мин. | V0 , мл | Δt | Δ V0 | Δ V0 / Δt | α |
| 1 | 0,2 | 1 | 0 | 0 | 0,9979 |
| 2 | 0,5 | 1 | 0,3 | 0,3 | 0,9948 |
| 3 | 0,9 | 1 | 0,4 | 0,4 | 0,9908 |
| 4 | 1,4 | 1 | 0,5 | 0,5 | 0,9857 |
| 5 | 2,0 | 1 | 0,6 | 0,6 | 0,9795 |
| 6 | 2,7 | 1 | 0,7 | 0,7 | 0,9724 |
| 7 | 3,3 | 1 | 0,6 | 0,6 | 0,9662 |
| 8 | 3,9 | 1 | 0,6 | 0,6 | 0,9601 |
| 9 | 4,4 | 1 | 0,5 | 0,5 | 0,9550 |
| 10 | 4,9 | 1 | 0,5 | 0,5 | 0,9499 |
| 11 | 5,3 | 1 | 0,4 | 0,4 | 0,9458 |
| 12 | 5,7 | 1 | 0,4 | 0,4 | 0,9417 |
| 13 | 6,1 | 1 | 0,4 | 0,4 | 0,9376 |
| 14 | 6,4 | 1 | 0,3 | 0,3 | 0,9345 |
| 15 | 6,6 | 1 | 0,2 | 0,2 | 0,9325 |
| 20 | 7,4 | 5 | 0,8 | 0,16 | 0,9243 |
| 40 | 8,2 | 20 | 0,8 | 0,04 | 0,916 |
| 60 | 8,6 | 20 | 0,4 | 0,02 | 0,9121 |
| 80 | 8,8 | 20 | 0,2 | 0,01 | 0,91 |
Каталазная активность мталлполимерного комплекса ПВПД:Cо2+ состава (1:6)
| t , мин. | V0 , мл | Δt | Δ V0 | Δ V0 / Δt | α |
| 1 | 0,1 | 1 | 0 | 0 | 0,9989 |
| 2 | 0,2 | 1 | 0,1 | 0,1 | 0,9979 |
| 3 | 0,2 | 1 | 0 | 0 | 0,9979 |
| 4 | 0,3 | 1 | 0,1 | 0,1 | 0,9969 |
| 5 | 0,3 | 1 | 0 | 0 | 0,9969 |
| 6 | 0,3 | 1 | 0 | 0 | 0,9969 |
| 7 | 0,4 | 1 | 0,1 | 0,1 | 0,9959 |
| 8 | 0,4 | 1 | 0 | 0 | 0,9959 |
| 9 | 0,5 | 1 | 0,1 | 0,1 | 0,9948 |
| 10 | 0,5 | 1 | 0 | 0 | 0,9948 |
| 11 | 0,6 | 1 | 0,1 | 0,1 | 0,9939 |
| 12 | 0,7 | 1 | 0,1 | 0,1 | 0,9928 |
| 13 | 0,8 | 1 | 0,1 | 0,1 | 0,9918 |
| 14 | 0,9 | 1 | 0,1 | 0,1 | 0,9908 |
| 15 | 1,0 | 1 | 0,1 | 0,1 | 0,9897 |
| 20 | 1,1 | 5 | 0,1 | 0,02 | 0,9887 |
| 40 | 1,4 | 20 | 0,3 | 0,015 | 0,9857 |
| 60 | 1,8 | 20 | 0,4 | 0,02 | 0,9815 |
| 80 | 2,1 | 20 | 0,3 | 0,015 | 0,9785 |
Каталазная активность мталлполимерного комплекса ПВПД:Cd2+ состава (1:6)
| t , мин. | V0 , мл | Δt | Δ V0 | Δ V0 / Δt | α |
| 1 | 0,2 | 1 | 0 | 0 | 0,9979 |
| 2 | 0,3 | 1 | 0,1 | 0,1 | 0,9969 |
| 3 | 0,3 | 1 | 0 | 0 | 0,9969 |
| 4 | 0,4 | 1 | 0,1 | 0,1 | 0,9959 |
| 5 | 0,4 | 1 | 0 | 0 | 0,9959 |
| 6 | 0,5 | 1 | 0,1 | 0,1 | 0,9948 |
| 7 | 0,5 | 1 | 0 | 0 | 0,9948 |
| 8 | 0,6 | 1 | 0,1 | 0,1 | 0,9939 |
| 9 | 0,7 | 1 | 0,1 | 0,1 | 0,9928 |
| 10 | 0,8 | 1 | 0,1 | 0,1 | 0,9918 |
| 11 | 0,8 | 1 | 0 | 0 | 0,9918 |
| 12 | 0,9 | 1 | 0,1 | 0,1 | 0,9908 |
| 13 | 1,0 | 1 | 0,1 | 0,1 | 0,9897 |
| 14 | 1,0 | 1 | 0 | 0 | 0,9897 |
| 15 | 1,1 | 1 | 0,1 | 0,1 | 0,9887 |
| 20 | 1,5 | 5 | 0,4 | 0,08 | 0,9846 |
| 40 | 3,5 | 20 | 2,0 | 0,1 | 0,9642 |
| 60 | 5,3 | 20 | 1,8 | 0,09 | 0,9458 |
| 80 | 6,8 | 20 | 1,5 | 0,075 | 0,9305 |
Похожие работы
... , определяющих эффективность лечебного действия полимерных материалов, является пролонгирование скорости перехода ЛВ. Регулирование кинетики выделения БАВ может быть достигнуто при использовании интерполиэлектролитных комплексов (ИПЭК). Пролонгированное высвобождение лекарственной основы в отсутствии ковалентной связи из ИПЭК происходит за счет диффузии низкомолекулярного БАВ в окружающую среду из ...
... оси ординат – соответствующее значение pH. Таблицы и графики представлены в приложении. 3.Экспериментальная часть 3.1Результаты и обсуждение Цель работы: 1. Исследование комплексообразования ПКЭАК с ионами двухвалентных металлов: Ca, Sr, Ni, Co, Cd, Pb, Zn, Cu. Полимер бетаиновой структуры синтезирован в институте полимерных материалов и технологий г. Алматы содержит в полимерной ...
... преломления, равном 1,48 для кремнийорганического полимера, и 1,49 для полиметилметакрилата, показатели преломления для нанокомпозитов составили 1,74. Проведенный анализ физико-химических свойств композиций на основе металлоорганосилоксанов дает возможность предположить, что данные материалы перспективны для создания на их основе оптически прозрачных диэлектрических наноматериалов для ...
... химическое, макроструктурное модифицирование и одновременное обогащение бентопорошка, позволяют повысить сорбционные свойства и качество готовой продукции. 3.4 Разработка полимерных композиционных материалов на основе органоглин на основе бентонита месторождения «Герпегеж» Объектами исследований в данной части работы являются нанокомпозиты, полученные на основе органомодифицированных ...




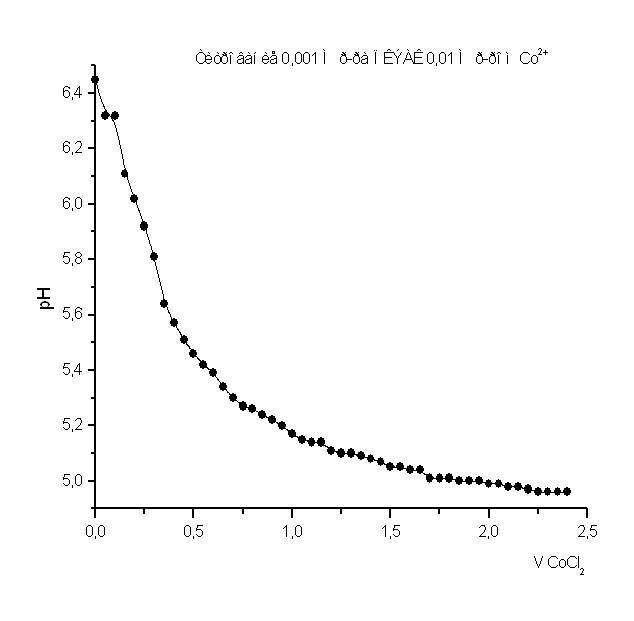

0 комментариев