Навигация
Фосфин
4.1.3. Фосфин
Фосфин (PH3) – бесцветный газ с запахом чеснока. Очень ядовит. Сгорает с образованием фосфорного ангидрида P2O5. С наиболее сильными кислотами (HClO4, HCl) образует соли фосфония PH4+ – очень непрочные соединения, которые при действии воды разлагаются на фосфин и HCl.
Cуществует несколько водородных соединений фосфора. Наиболее изучены РН3 (фосфин), а также Р2Н4 - жидкий фосфористый водород (дифосфин). Наибольшую известность и практическое значение имеет газообразный РН3. При комнатной температуре он представляет собой бесцветный, тяжёлый (пл.1.53 г/дм), чрезвычайно ядовитый газ с неприятным запахом.
Максимальная концентрация его в воздухе при 8-часовом рабочем дне не должна превышать 0,3 млн-1. Концентрация в 50-100 млн-1 переносима без осложнений лишь очень короткое время, концентрация в 400 млн-1 ведёт к моментальной смерти, что служит серьёзным препятствием для его практического использования . Ниже –87,8o С фосфин - бесцветная жидкость, которая затвердевает при –133,5 о С. Вплоть до температур в несколько сот градусов его диссоциация незначительна. Константа скорости распада при 500о С составляет около 8.10-3 сек-1. Фосфин является сильным восстановителем, самопроизвольно реагирует при комнатной температуре с хлором, образуя хлориды фосфора и НCl. Чистый газ воспламеняется на воздухе при 150о С. Загрязненный примесями газ (следы дифосфина Р2Н4 или тетрафосфора Р4) может самовоспламеняться при комнатной температуре. Условия воспламенения фосфина и кислорода зависят от состава смеси, содержания воды, присутствия инородных газов и температуры. Окисление фосфина происходит по цепному механизму и имеет пределы критического давления:
0: + РН3 РН + НОН
РН + 02 НРО + 0:
Первая стадия проходит быстро, поскольку она экзотермична и, вероятно, включает перенос не спаренного электрона от кислорода к фосфору (p*- уровень кислорода может быть по энергии выше, чем 3d-уровень фосфора). Продукты окисления состоят из различных кислот фосфора (Н3РО2, Н3РО3, Н3РО4 и т.д.) и воды.
Фосфин почти не образует водородных связей и об отсутствии межмолекулярной ассоциации в РН3 свидетельствуют аномальное соотношение температур плавления и кипения РН3 (-133,3о;-87,4o C) и NH3 (-77,75o;-33,35o C). На это указывает также низкая по сравнению с NH3 растворимость фосфина в воде. В 100 мл воды при 17о С растворяется 22,8 мл газообразного РН3. Водный раствор является одновременно и слабой кислотой и слабым основанием. Обмен дейтерия между D2О и РН3 протекает в кислом растворе через РН4+-ион, в основном растворе через РН2--ион. Из кинетических данных и принятого механизма обмена авторы для равновесной постоянной реакции рассчитали:
РН3 + НОН = РН2- + Н3О+, kкисл.= 1,6.10-29;
РН3 + НОН = РН4+ + ОН-, kосн. = 4.10-28
Несколько лучше он растворяется в органических растворителях: бензине, хлороформе и четырёххлористом углероде. Молекула фосфина полярна (m = 0,58) и имеет форму тригональной пирамиды c атомом фосфора в вершине. Все три атома водорода в молекуле равноценны, расстояние Р-Н составляет 1,419 А, высота пирамиды 0,764 А, угол связи Н-Р-Н 93,7, энергия связи Р-Н 77 ккал/моль. Образование связей Р-Н происходит за счёт р-орбиталей фосфора, а не поделенная пара электронов имеет сферическую симметрию и расположена на s-орбитали. Участие d-орбиталей в образовании связей, по-видимому, невелико. Такое строение фосфина чрезвычайно затрудняет образование донорно-акцепторных связей с его участием как донора электронов. Именно затруднение sp3_гибридизации орбиталей атомов фосфора обуславливает слабость донорных свойств фосфина и соответственно его плохо выраженные основные свойства. Этим объясняется малый дипольный момент молекулы РН3, уменьшение основности и способности к координации по сравнению с аммиаком, устойчивость и нейтральность фосфина в обычных условиях. Присоединение протона к РН3 (переход 3р ® 3sр3) сопровождается перестройкой валентных углов и протекает с большой затратой энергии, поэтому соли фосфония известны лишь для немногих кислот (НСIО4, НВr, НI), причём они весьма нестойки.
Фосфин способен осаждать тяжёлые металлы из их солей. Окисление проходит через стадию образования комплексного соединения металл-фосфин. Эффективными окислителями выступают металлы, у которых на d-оболочке больше 5, но меньше 10 электронов. Не поделенная пара электронов фосфора молекулы РН3 может передаваться на ds- орбиталь металла, образуя координационную связь. Согласно теории поля лигандов, среди группы d–орбиталей металла ds–орбитали всегда относятся к наивысшим энергетическим уровням. Поэтому соответствующая ds-орбиталь (dz2, dx2-y2) будет вакантной и способной к координационному связыванию фосфина. Вакантные dp-орбитали фосфора участвуют в образовании p-дативной связи М ® РН3. Комплексы с фосфином сравнительно немногочисленны, а соединения, в которых РН3 единственный лиганд, редки.
Фосфин, первичные и вторичные фосфины образуют комплексы с солями Al, Ti, Cu, Ni, Co, Fe, Pd, Pt и других металлов. Комплексообразование РН3 с различными металлами переменной валентности, проблемы катализа реакций окисления фосфина в отходящих газах химических производств широко освещены в работах .
Жидкий гидрид фосфора Р2Н4 представляет собой бесцветную жидкость с температурой кипения 60оС, самовозгорающуюся на воздухе. На свету происходит самопроизвольный распад Н2Р-РН2:
3 Р2Н4 2 РН3 + Р4Н2 + 2Н2В отличие от гидразина H2N-NH2 (стехиометрического аналога Н2Р-РН2), жидкий фосфористый водород Р2Н4 не обладает основными свойствами из-за слабости донорных свойств фосфора, проявляющихся даже у РН3. Твёрдый гидрид фосфора Р4Н2 – жёлтое твёрдое вещество, загорающееся на воздухе выше 160оС.
Похожие работы
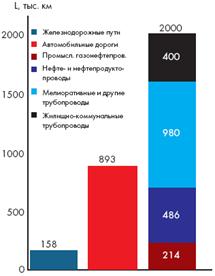
... срок их эксплуатации и необходимость проведения ремонтных и защитных работ после 8-10 лет их использования, проведения дополнительных испытаний, внутритрубной диагностики [18]. Преимущества трубопроводного транспорта: · Возможность повсеместной укладки трубопровода. · Низкая себестоимость транспортировки. · Сохранность качества благодаря полной герметизации трубы. · Меньшая материало ...
я характеристика, даваемая влажноэкваториальному ландшафту, применима именно к западной части Амазонской низменности. Здесь шире всего (до 1300 км с севера на юг) расступились окружающие ее возвышенности, и прогиб между ними оказался наиболее глубоким. Гранитное основание Гвианского массива выступает по верхней Риу-Негру и Какете, кристаллические же породы фундамента Бразильского нагорья вскры ...
... предыдущего чрезмерного стравления, в восстановлении будут преобладать разновидности сорняков. Глава 3. Проблемы горных территорий и возможные способы их решения. Природные и антропогенные катаклизмы. Природные катаклизмы в горах представляют результат геотектонической природы гор и их экологических характеристик. Однако катаклизмы зачастую вызываются деятельностью человека. Перед ...
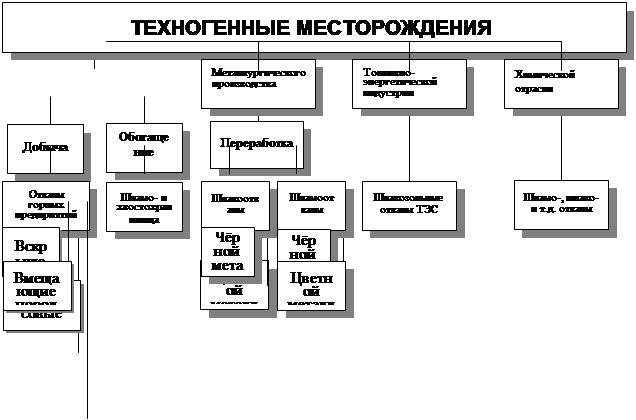
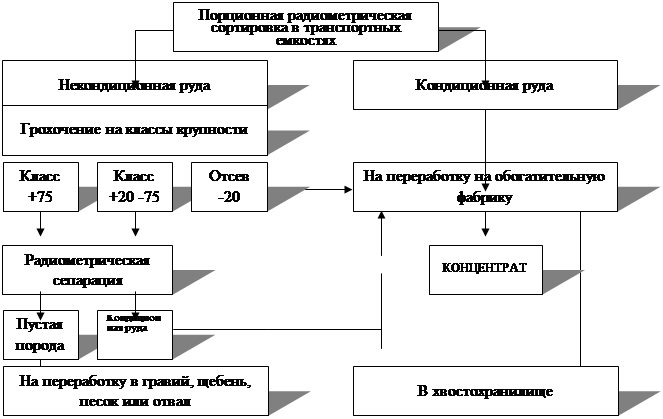
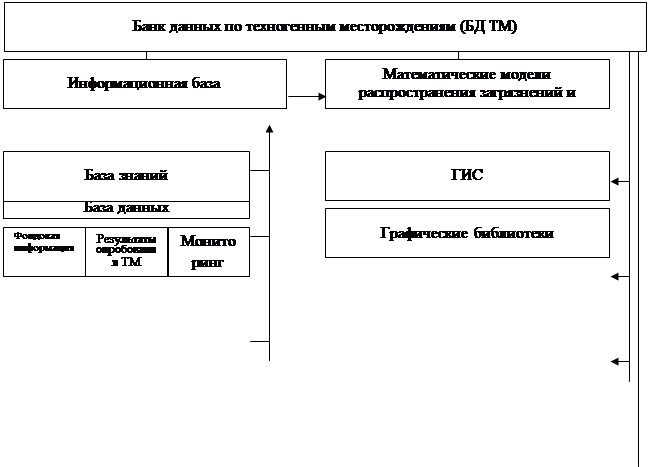
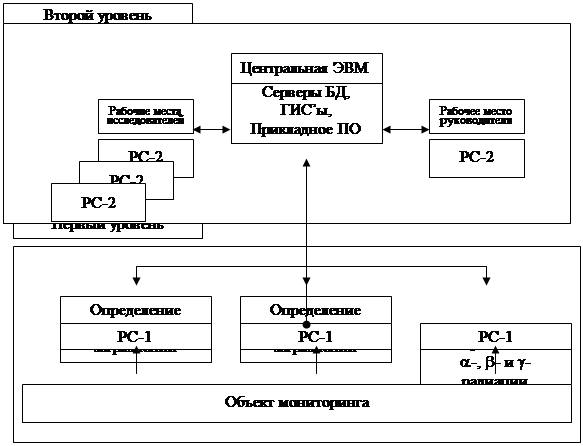
... занижение платежей за загрязнение ОС, складирование отходов и изъятие земель составило по АО «Свердловэнерго» в 1996 г. 2,33 млрд. рублей. 5.1. Технология формирования банка данных по техногенным месторождениям (БД ТМ) Технология построения БД ТМ основана на объединении: информационной базы и математических моделей распространения загрязнений в ОС (воздушном и водном бассейнах, почвах, донных ...






0 комментариев