Навигация
Реакция Белоусова-Жаботинского
2.1.2. Реакция Белоусова-Жаботинского
Современный этап в исследовании колебательных химических реакций начался со случайного открытия, сделанного в 1951г. Б.П.Белоусовым. Он заметил, что в ходе реакции окисления лимонной кислоты броматом BrO3-, катализируемой ионами церия, были обнаружены регулярные периодические колебания окраски раствора от бесцветной (цвет ионов Се3+) к желтой (цвет ионов Се4+) и наоборот. Белоусов показал, что период колебаний сильно уменьшается с повышением кислотности среды и температуры. Колебания можно было легко наблюдать визуально, а их период находился в пределах 10-100 с, совпадая с естественным масштабом времени человека-наблюдателя.
В 1961 году А. М. Жаботинский, тогда аспирант МГУ, начал исследования в этой области. Хотя Жаботинский не имел тогда статьи Белоусова, он имел доступ к первоначальному рецепту. На первом этапе исследовались в основном реакции в условиях постоянного перемешивания. Он выяснил, что в качестве катализатора вместо церия можно применять марганец и железо, а в качестве восстановителя в реакции Белоусова можно использовать ряд органических соединений, либо имеющих метиленовую группу, либо образующих ее при окислении. К таким соединениям относятся малоновая и броммалоновая кислоты. Обычно реакция проводят при 250С в сернокислом растворе смеси бромата калия, малоновой и броммалоновой кислот и сернокислого церия. А.М. Жаботинский провел подробные исследования колебаний в системе с малоновой кислотой, которая оказалась более удобным восстановителем, так как протекание реакции не осложнялось газовыделением [12].
В реакции Белоусова - Жаботинского при взаимодействии ионов Ce4+ с малоновой кислотой происходит их восстановление:
Ce4 + + C3H3O4 →Ce3 + + продукт (1)
Образующийся в ходе реакции Ce3 + должен затем вступить в реакцию с бромат - ионом:
Ce3 + + HBrO3 → Ce4 + + продукт (2)
В результате происходит стационарное распределение церия между степенями окисления. Однако, реакция (2) относится к автокаталитическим, и в ней самоускоряющемуся протеканию предшествует период индукции, то есть реакция включается не сразу. Поэтому за время периода индукции практически все ионы Ce4+ переходят в Ce3+. При этом окраска раствора, обусловленная поглощением света в видимой области спектра комплексом Ce4+ с малоновой кислотой, исчезает. По завершении периода индукции происходит самоускоряющийся быстрый переход ионов Ce3+ в Ce4+ и раствор окрашивается вновь.
Периодический характер процесса (предполагается, что в исходной системе содержится некоторое количество Ce4+) можно объяснить следующим образом. В результате реакции (1) образуются бромид-ионы, замедляющие реакцию (2). Однако концентрация бромида в системе зависит от скорости реакции, в которой бромид расходуется за счет взаимодействия с броматом. Если концентрация бромида достаточно высока, то реакция (2) прекращается, так как Ce4 + не регенерируется при окислении Ce3+ броматом, и в результате каталитический цикл прерывается. Когда концентрация Ce4 +, уменьшающаяся в результате реакции (1), достигает минимально возможного значения, концентрация Br- начинает резко уменьшаться. Тогда реакция (2) заметно ускоряется и концентрация Ce4 + растет до некоторого значения, при котором концентрация бромида начинает быстро увеличиваться, замедляя тем самым реакцию (2). Затем весь цикл повторяется.
Механизм реакции весьма сложен с химической точки зрения и содержит десятки промежуточных стадий [13]. Выделим основные стадии, которые определяют колебательный характер реакции.
Это:
1) окисление трехвалентного церия броматом:

2) восстановление четырехвалентного церия малоновой кислотой (МК):
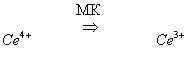
Продукты восстановления бромата, образующиеся на стадии 1, бромируют МК. Получающиеся бромопроизводные МК разрушаются с выделение Br-.
Когда реакция происходит в хорошо перемешиваемой среде, в некоторой области начальных концентраций наблюдаются колебания концентраций, которые имеют период порядка минуты и продолжаются около часа. Например, при взаимодействии Ce4+ с малоновой кислотой в присутствии бромат-иона раствор периодически окрашивается то в вишнево-красный цвет, то становится бесцветным. Такие химические часы будут тикать до тех пор, пока в системе есть бромат и малоновая кислота. Временная периодичность может быть переведена и в пространственную. Капля реактива, нанесенная на подложку из желатина или агар-агара, за счет диффузии рисует великолепные кольца, а две капли создают настоящую интерференционную картину. Постепенно колебания затухают, поскольку система замкнута и в нее не поступают исходные вещества, необходимые для протекания реакции. Если реакцию проводить в длинной трубке, в ней можно наблюдать возникновение горизонтальных зон, соответствующих чередующимся областям высоких концентраций. Наконец, если реакция протекает в тонком перемешиваемом слое, например, в чашке Петри, можно наблюдать различные типы волновой активности- это и концентрационные волны с цилиндрической симметрией, и вращающиеся спиральные волны.
0 комментариев