Навигация
Описание экспериментальной установки
3.3.1. Описание экспериментальной установки
Исследование реакции окислительного карбонилированию алкинов проводилось в закрытой системе. Установка состояла из газометра, заполненного смесью газов (СО+О2+МА), соединяющегося с заполненной водой бюреткой, служащей для измерения объема поглощаемых в ходе опыта газов, стеклянного реактора объемом 200мл с обратным холодильником, сосуда Мариотта для продувки системы смесью газов. Объем жидкой фазы в реакторе составлял 10мл. Перемешивание раствора производилось с помощью магнитной мешалки. В ходе опытов реактор термостатировали с помощью термостата. Опыты производились при температуре 400С и давлении смеси СО+О2+МА = 1атм. Ввод реагентов и отбор проб реакционного газа производили шприцем через специальные штуцера. Для измерения разности потенциалов (Ept) использовался платиновый электрод марки ЭС – 10601/7, для измерения рН среды – стеклянный марки ЭВЛ – 1М 3.1. В качестве вспомогательного электрода использовался проточный хлорсеребряный электрод. Электролитический мостик и хлорсеребряный электрод заполнялись насыщенным раствором КCl в метаноле.
3.3.2. Методика проведения опытов
Общая методика эксперимента заключалась в следующем. В сухой термостатированный при 400С реактор с установленными электродами загружали навеску галогенида металла, служащих для улучшения растворения катализатора и метанол, перемешивали 15мин, затем загружал навеску палладиевого катализатора и перемешивали раствор ещё 25 мин. Реактор продували смесью газов СО и О2 (объём продуваемого газа не менее 500мл., состав газа в реакторе контролировали хроматографически). Затем с помощью шприца вводили через пробоотборник - фенилацетилен в метаноле, доводя общий объём раствора до 10 мл. Момент ввода алкина считали началом опыта. В ходе опыта измеряли рН и Ept, а также изменение объёма газа в реакторе. Периодически отбирали пробы реакционного газа и анализировали их методом газоадсорбционной хроматографии с использованием насадочных колонн длиной 3м, диаметром 3мм, заполненных активированным углём АР-3 (определяли содержание воздуха, СО, СО2) и молекулярными ситами 13Х (определяли содержание О2, N2, CO). И в том и другом случае использовали фракцию с размером частиц 0,25-0,5 мм, детектор-катарометр, газ-носитель – аргон.
1) Тдет. = 1600С; Tисп. = 1700С; Ткол. = 1500С; Iдет. = 70 мА
2) Ткол. = 500С; Tдет. = 800С; Iдет. = 80 мА;
Для расчета концентраций компонентов газовой смеси использовался метод внутренней нормализации. При этом содержание i-го компонента рассчитывали по формуле:
N
Сi= (ki. Hi. Mi)/(å ki. Hi. Mi)
i =1
где Сi- концентрация i-го компонента газовой смеси;
Hi- высота хроматографического пика;
ki - поправочный коэффициент;
Mi - масштаб;
N - число компонентов газовой смеси.
Таблица 3.6.1. Поправочные коэффициенты и масштабы
| Компонент | О2 | СО | СО2 | воздух | азот |
| Коэффициент | 1,00 | 1,22/4,077* | 4,4 | 1,00 | 1,794 |
| Масштаб | 30 | 30/30* | 1 | 30 | 30 |
*- на разных хроматографах
.4.Результаты экспериментов
Таблица 3.4.
Экспериментальные данные по окислительному карбонилированию фенилацетилена и метилацетилена.
| Иссл. система | Дата | Реагирующая система | Наличие колебаний | Примечание |
| 1 | 21.01.05 | KI=0,4M; PdI2=0,05M; VCH3OH=10мл;МА:CO:O2=5:3:2 | + | Ввели ТЭА=6мкл |
| 2 | 27.01.05 | KI=0,4M; PdCl2=0,05M; VCH3OH=10мл;МА:CO:O2=5:3:2 | + | Ввели ТЭА=3мкл |
| 3 | 28.01.05 | KCl=0,4M; PdCl2=0,05M; VCH3OH=10мл;МА:CO:O2=5:3:2 | - | |
| 4 | 3.02.05 | LiBr=0,4M; PdBr2=0,05M; VCH3OH=10мл;МА:CO:O2=5:3:2 | + | Ввели ТЭА=3мкл |
| 5 | 4.02.05, 1.02.06 | LiBr=0,4M; PdBr2=0,05M; VCH3OH=10мл;МА:CO:O2=5:3:2 | + | |
| 6 | 17.02.05, 18.02.05, 17.03.05, 24.03.05, 25.03.05, 31.03.05, 1.04.05, 7.04.05, 8.04.05, 4.07.05, 6.07.05, 6.09.05, 9.09.05 | LiBr=0,4M;PdBr2=0,05M; VCH3OH=10мл;Ф А=0,1М; CO:O2=3:2 | + | |
| 24.02.05 | LiBr=0,4M;PdBr2=0,05M; VCH3OH=10мл;Ф А=0,1М;CO:O2=3:2 | - | Остановка перемешивания | |
| 10.03.05 | LiBr=0,4M;PdBr2=0,05M; VCH3OH=10мл;Ф А=0,1М; CO:O2 = 3:2 | - | рН не фиксировали | |
| 18.03.05 | LiBr=0,4M;PdBr2=0,05M; VCH3OH=10мл;Ф А=0,1М; CO:O2 = 3:2 | + | Дополн. продувка газом V=500мл | |
| 17.07.05 | LiBr=0,4M;PdBr2=0,05M; VCH3OH=10мл;Ф А=0,1М; CO:O2 = 3:2 | + | Т=300С | |
| 2.09.05 | LiBr=0,4M;PdBr2=0,05M; VCH3OH=10мл;Ф А=0,1М; CO:O2 = 3:2 | - | Периодическая остановка перемешивания | |
| 7 | 13.09.05, 14.09.05, 15.09.05, 16.09.05 | LiBr=0,4M;PdBr2=0,05M; VCH3OH=10мл;Ф А=0,1М; CO:O2=3:1 | - | |
| 8 | 21.09.05, 23.09.05, 25.09.05, 26.09.05, 28.09.05, 3.10.05, 4.10.05, 6.10.05, 11.10.05, 14.10.05 | LiBr=0,4M;PdBr2=0,05M; VCH3OH=10мл;Ф А=0,1М; CO:O2=1:1 | + | |
| 9 | 27.09.05 | LiBr=0,4M;PdBr2=0,05M; VCH3OH=10мл;Ф А=0,1М; CO:O2=1:1 | + | Периодическая остановка перемешивания |
| 10 | 18.10.05 | LiBr=0,4М;PdBr2=0,05М; VCH3OH=8мл; ФА =0.1М; CO:O2 = 1:2 | + | Ввели 2 мл ацетона |
| 19.10.05, 20.10.05, 21.10.05 | LiBr=0,4M;PdBr2=0,05M; VCH3OH=10мл; ФА=0,1М; CO:O2=1:2 | + | ||
| 24.10.05 | LiBr=0,4M;PdBr2=0,05M; VCH3OH=10мл;Ф А=0,1М; CO:O2=1:2 | + | Опыт без термостата | |
| 11 | 25.10.05, 26.10.05 | KI=0,4М;PdBr2=0,05М; ФА =0.1М;VCH3OH=10мл; CO:O2 = 1:2 | + | |
| 12 | 28.10.05 | KI=0,2М;LiBr=0,2M;PdBr2=0,05M;VCH3OH=10мл;Ф А=0,1М; CO:O2=1:1 | - | |
| 13 | 31.10.05, 9.11.05, 14.11.05, 16.11.05 | LiI=0,4М;PdBr2=0,05М; ФА =0.1М;VCH3OH=10мл; CO:O2 = 1:2 | - | |
| 14 | 23.11.05, 29.11.05, 2.12.05 | LiI=0,4М;PdBr2=0,05М; VCH3OH=8мл; ФА =0.1М; CO:O2 = 1:1 | - | Быстро восст-ся кат.система |
| 30.11.05 | LiI=0,4М;PdBr2=0,05М; VCH3OH=8мл; ФА =0.1М; CO:O2 = 1:1 | - | Ввели ТЭА=8мкл | |
| 15 | 7.12.05, 9.12.05 | LiBr=0,4M;PdI2=0,05M; VCH3OH=10мл;Ф А=0,1М; CO:O2=1:1 | - | |
| 16 | 19.12.05 | KBr=0,4М; PdI2=0,05М; ФА =0.1М;VCH3OH=10мл; CO:O2 = 1:1 | - | |
| 17 | 26.12.05, 28.12.05 | KBr =0,4М;PdBr2=0,05М; ФА =0.1М;VCH3OH=10мл; CO:O2 = 1:1 | - | |
| 18 | 11.12.05 | KI=0,4М;PdCl2=0,05М; ФА =0.1М;VCH3OH=10мл; CO:O2 = 1:1 | + | |
| 19 | 13.01.06 | LiBr=0,4M;PdBr2=0,05M; VCH3OH=10мл;Ф А=0,1М; CO:O2=1:1 | - | Ввели 5% масс. ацетона |
| 20 | 18.01.06 | LiBr=0,4M;PdBr2=0,05M; VCH3OH=10мл;Ф А=0,1М; CO:O2=1:1 | + | Ввели 10% масс. ацетона |
| 21 | 25.01.06 | LiBr=0,4M;PdBr2=0,05M;VCH3OH=10мл;Ф А=0,1М;CO:O2=3:2 | - | Ввели 5% масс. ацетона |
| 22 | 10.02.06 | KI=0,4М;PdBr2=0,05М; VCH3OH=10мл; МА:CO:O2=5:3:2 | + |
4.Обсуждение результатов
Полученные ранее на кафедре ХТООС МИТХТ им. М.В.Ломоносова данные [25, 26] показывают, что в системах KI - PdI2 – фенилацетилен (ФА) и KI - PdI2 – метилацетилен (МА) наблюдаются развитые релаксационные автоколебания Еpt и рН, которым соответсвуют ступенчатые кривые поглощения смеси газов.
4.1.Замена аниона в соединении палладияВ результате проведённых экспериментов было показано, что при замене PdI2 на PdCl2 также наблюдаются устойчивые колебания Еpt и рН, однако для выхода на режим колебаний при карбонилировании МА необходимо вводить основание – триэтиламин (ТЭА) (рис.4.1.1). Опыты с ФА протекали в данной системе без добавок ТЭА (рис.4.1.2).
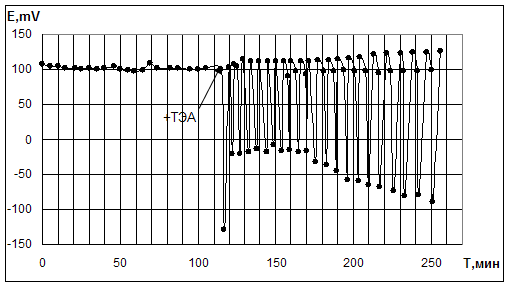
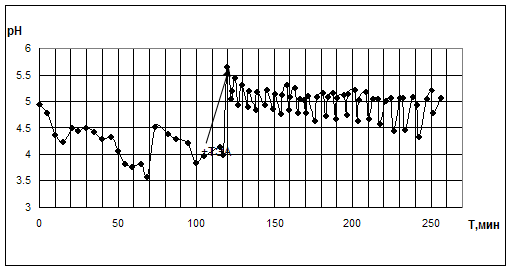
Рис. 4.1.1. Опыт по окислительному карбонилированию МА в системе KI - PdCl2.
KI=0,4M; PdCl2=0,05M; ТЭА=0,003М; VCH3OH=10мл; [MA]0: [CO]0: [O2]0 = 5:3:2
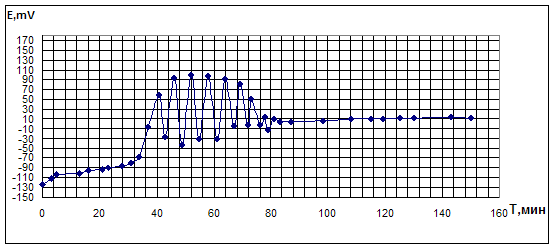
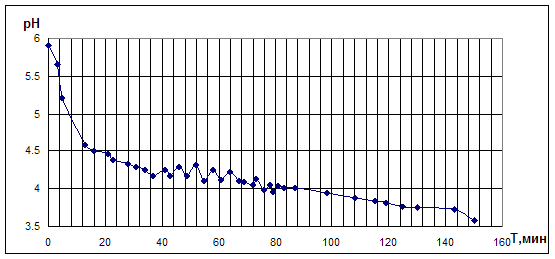
Рис. 4.1.2. Опыт по окислительному карбонилированию ФА в системе KI - PdCl2.
KI=0,4M; PdCl2=0,05M;ФА=0,1М; VCH3OH=10мл; [CO]0: [O2]0 = 1:1
В системе KI - PdBr2 также наблюдались колебания похожего вида, они продолжались в среднем около двух часов, однако протекали при немного более низких значениях рН, равных 3,0-4,0. Эти опыты проводили с использованием ФА (рис.4.1.3) и МА (рис.4.1.4) в качестве субстрата.
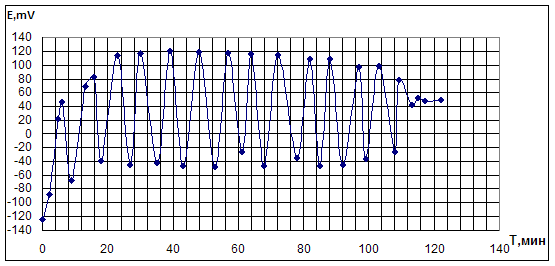

Рис.4.1.3. Опыт по окислительному карбонилированию ФА в системе KI - PdBr2.
KI=0,4M; PdBr2=0,05M; ФА=0,1М; VCH3OH=10мл; [CO]0: [O2]0 =1:2
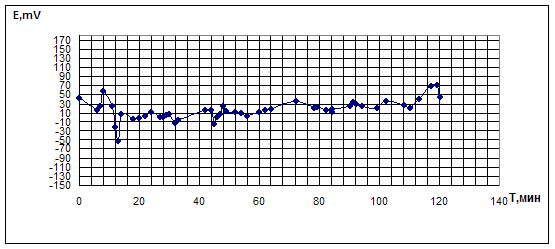
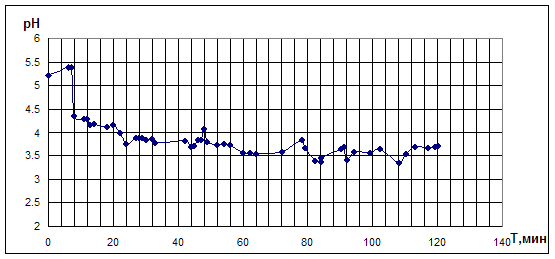
Рис.4.1.4. Опыт по окислительному карбонилированию МА в системе KI - PdBr2.
KI=0,4M; PdBr2=0,05M; VCH3OH=10мл; [MA]0: [CO]0: [O2]0 = 5:3:2
Из приведённых данных можно сделать вывод о том, что природа аниона влияет на характеристики (период, амплитуда) колебаний.
4.2.Исследование систем, содержащих бромиды калия и литияВо всех опытах предыдущей серии в реакционной системе присутствовали иодид-анионы, это, как может показаться на первый взгляд, обеспечивает необходимые условия для возникновения колебаний в системе. Для проверки этого положения был проделан ряд экспериментов, в которых иодид-анион вводили только в составе PdI2, а вместо иодида калия использовали бромиды калия и лития. Ни в одном опыте этой серии колебаний зафиксировано не было, что может говорить о более сложном, чем предполагалось изначально, характере влияния иодид-анионов в системе.
Характер изменения Еpt и рН был похожими для опытов с бромидами калия и лития, хотя абсолютные значения различались. Потенциал в начале опыта падал на 50-100 мВ, достигая 14-17 минуте своего минимума (-50 ÷ -60мВ), затем плавно рос, выходя к 60 минуте опыта на постоянное значение (230 мВ для KBr; и 100 мВ для LiBr). рН синхронно с изменениями Еpt падал к 14-17 минуте опыта, оставаясь затем постоянным, или медленно уменьшаясь до 0,5-2,0 (рис.4.2.1.,4.2.2)
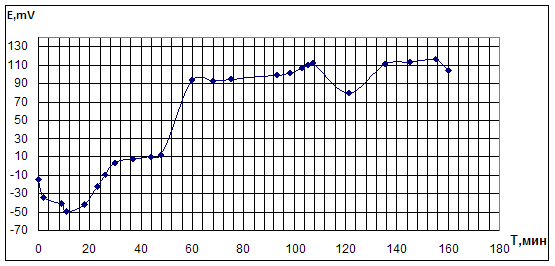
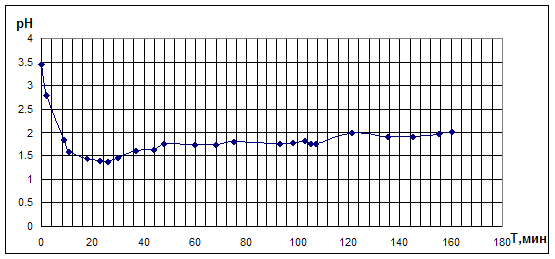
Рис.4.2.1. Опыт по окислительному карбонилированию ФА в системе LiBr - PdI2.
LiBr=0,4M; PdI2=0,05M; ФА=0,1М; VCH3OH=10мл; [CO]0: [O2]0 =1:1
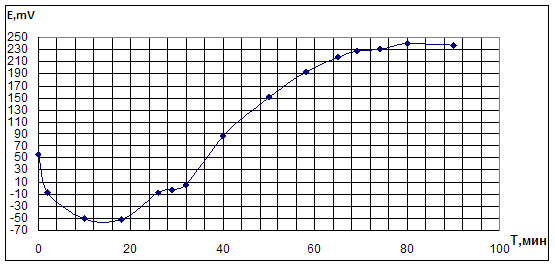
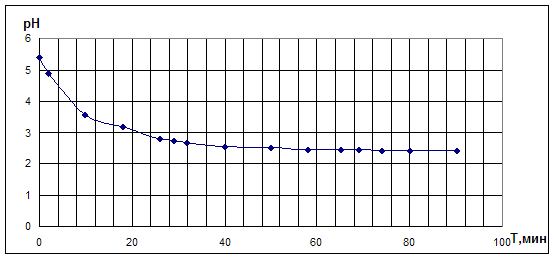
Рис.4.2.2. Опыт по окислительному карбонилированию ФА в системе KBr - PdI2.
LiBr=0,4M; PdI2=0,05M; ФА=0,1М; VCH3OH=10мл; [CO]0: [O2]0 =1:1
4.3.Исследование систем c бромидами палладияВ этой серии экспериментов изучались системы, включающие PdBr2 и LiI или LiBr. Для этой серии характерна плохая воспроизводимость опытов, что, возможно, связано с узким диапазоном начальных концентраций, входящих в систему реагентов, который обеспечивает наличие колебательного режима. Колебания, которые удалось зафиксировать, имеют устойчивый характер и носят черты хаотичности. Также следует отметить, что системы с PdBr2 имеют довольно низкое значение рН – от 0 до 2. В начале опыта после продувки системы смесью газов часто наблюдается восстановление PdBr2. В подобных случаях в опытах с МА внесение триэтиламина приводило к появлению колебаний, однако они были далеки от стабильных (рис.4.3.1,4.3.2,4.3.3). Кроме того, до конца не ясна роль триэтиламина и других оснований в инициировании колебаний.
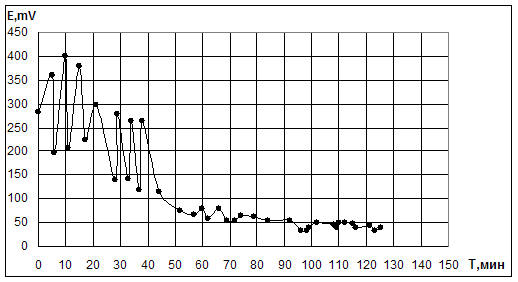

Рис. 4.3.1. Опыт по окислительному карбонилированию МА в системе LiBr - PdBr2.
LiBr =0,4M; PdBr2=0,05M; ТЭА=0,003М; VCH3OH=10мл; [MA]0: [CO]0: [O2]0 = 5:3:2
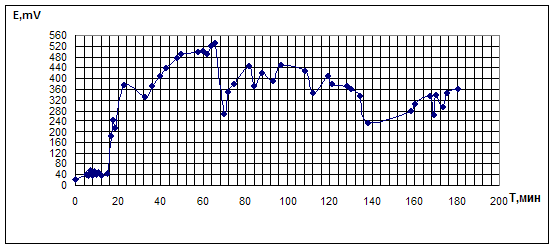
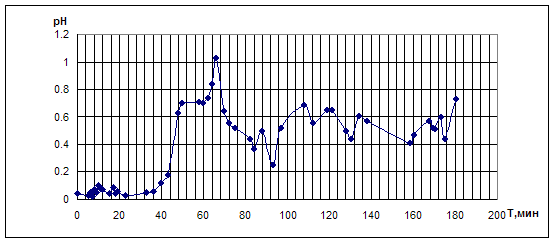
Рис. 4.3.2. Опыт по окислительному карбонилированию ФА в системе LiBr - PdBr2.
LiBr =0,4M; PdBr2=0,05M; ФА=0,1М; VCH3OH=10мл; [CO]0: [O2]0 = 3:2
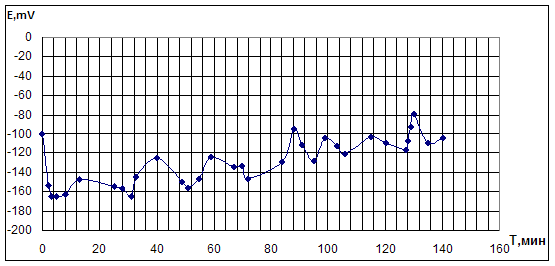
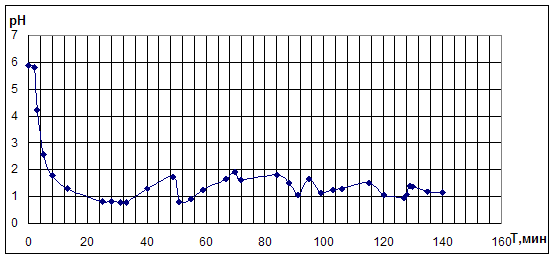
Рис. 4.3.3. Опыт по окислительному карбонилированию ФА в системе LiI - PdBr2.
LiI =0,4M; PdBr2=0,05M; ФА=0,1М; VCH3OH=10мл; [CO]0: [O2]0 = 3:2
Кроме перечисленных, у исследуемых бромидных систем было обнаружено ещё одно, не встречавшееся ранее, свойство: кривая поглощения смеси газов в случае колебательных опытов, а колебательный характер (рис.4.3.4.). Причём, эти колебания происходят синхронно с колебаниями Ept и pH.
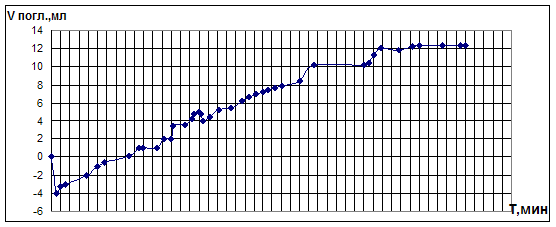
Рис. 4.3.4. Поглощение смеси газов в опытах по окислительному карбонилированию ФА.
КI=0,4M; PdBr2=0,01M; ФА=0,1М; VCH3OH=10мл
Этот феномен можно попытаться объяснить периодическим поглощением и выделением каталитической системой молекул газовой смеси (СО, О2). Механизм этого явления будет изучен в будущем.
4.4 Выводы1. Найдены новые каталитические системы, в которых окислительное карбонилирование алкинов протекает в режиме автоколебаний.
2. Изучена связь между составом каталитической системы и вероятностью появления режимов автоколебаний и их характеристиками.
3. Обнаружено, что синхронность Ept и рН нарушается в каталитической системе KI=0,4M; PdCl2=0,05M; ТЭА=0,003М; VCH3OH=10мл; [MA]0: [CO]0: [O2]0 = 5:3:2. Причины этого эффекта будут изучены в ходе дальнейших исследований.
0 комментариев