Навигация
Приготовление бактериальной суспензии
2.2.8 Приготовление бактериальной суспензии
Стерильную жидкую синтетическую среду разливают в стерилизованные конические колбы по 100 см3.
Для получения биомассы исследуемой культуры микроорганизмов, делают посев на скошенный агар.
Подготовленные таким образом культуры инкубируют в термостате 24 ч при температуре (38±5)°С, по окончании чего в пробирки с микроорганизмами вводят 5 см3 соответствующей жидкой синтетической среды, осуществляя процесс механического воздействия. Приготовленную таким образом бактериальную суспензию вносят в колбы, содержащие по 100 см3 соответствующей жидкой синтетической среды.
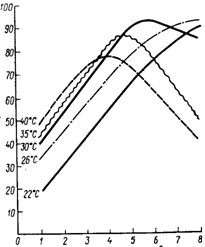
Культивирование микроорганизмов проводят в термостате при температуре 38±5°С, с переменным механическим воздействием, осуществляемом на Shaker Type, с частотой колебаний 200 об/мин, амплитудой 6 по 2 ч в сутки.
2.2.9 Определение протеолитических свойств микроорганизмов
Протеолитические свойства проявляются выделением во внешнюю среду протеолитических ферментов, которые расщепляют белки до промежуточных продуктов (пептоны, полипептиды, аминокислоты) или до продуктов конечного распада (индол, сероводород, аммиак и др.)
Для выявления протеолитических ферментов исследуемую культуру засевают в питательную среду, содержащую тот или иной белок (МПЖ, молоко и др.)
Посевы в МПЖ культивируют 5...7 суток при комнатной температуре, так как желатин расплавляется в термостате. Микробы, обладающие протеолитическими свойствами, разжижают желатин. Многие протеолитические микроорганизмы дают разный характер разжижения: послойное (идущее ровно, сверху вниз), воронкообразное, кратерообразное, реповидное, в форме чулка и т. д.; микроорганизмы, не обладающие протеолитической способностью, дают в МПЖ рост без разжижения желатина.
2.2.10 Определение индолообразования
Определение индола проводят по методу Морелли, путем использования полосок фильтровальной бумаги, смоченных горячим насыщенным раствором щавелевой кислоты (12 %-ным) и высушенных термостате. Бумажки помещали под пробку в пробирку с бульонной культурой. Культуру выращивают в течении трех суток в термостате, после чего определяют резуьлтаты взаимодействия продуктов жизнедеятельности микроорганизмов с щавелевой кислотой. Положительная реакция – порозовение нижней части бумажки.
2.2.11 Обнаружение сероводорода
Для обнаружения сероводорода делается посев уколом (внутрь столбика) по стенке в агар с ацетатом свинца (МПА с 5 % пептона и 0,25 % ацетата свинца) или в пробирку с МПБ, в которую под пробку над средой помещается полоска стерильной фильтровальной бумаги, пропитанной раствором ацетата свинца. Если исследуемая культура при разложении белка выделяет сероводород, то появляется темно-бурое окрашивание (почернение) по месту укола в плотной среде или на фильтровальной бумажке (в МПБ).
2.2.12 Определение аммиака
Определение аммиака начинают с того, что под пробирку с бульонной культурой помещают розовую лакмусовую бумажку, культуру термостатируют при 370С в течение 1...3 суток. При наличии аммиака лакмусовая индикаторная бумажка приобретает синюю окраску.
2.2.13 Определение редуцирующей способности
Редуцирующую способность определяют посевом культуры на молоко с метиленовым синим. К стерильному молоку добавляют по капле 1 %-ный водный раствор метиленового синего до голубого окрашивания. После культивирования засеянного материала бактерии, обладающие редуцирующей активностью, обесцвечивают лакмусовое молоко (под редукцией понимают химический процесс, заключающийся в отщеплении от вещества кислорода или присоединении к нему водорода).
2.2.14 Определение каталазы
Для определения каталазы в 3...5 суточную бульонную культуру, выращенную в пробирке, вносят 1 см3 3 %-ного раствора пероксида водорода. При наличии фермента каталазы обнаруживают обильное выделение пузырьков отщепленного кислорода, т.е. образуется так называемая “пенистая шапка”.
2.2.15 Определение сахаралитической способности («пестрый» ряд)
Микроорганизмы характеризуются неодинаковой способностью использовать различные соединения углерода для конструктивного и энергетического обмена. Для идентификации большинства гетеротрофных микроорганизмов необходимо определить, какие углеродсодержащие вещества обеспечивают рост данного организма и какими изменениями среды сопровождается его рост.
Как правило, используют следующие углеводы: арабинозу, ксилозу, глюкозу, фруктозу, галактозу, сахарозу, лактозу, мальтозу и спирты – глицерин и маннит.
Готовят среду основного состава на водопроводной воде (г/дм3): пептон – 5,0; гидрофосфат калия (К2НРО4) – 1,0 и индикатор Андреде: кислый фуксин – 0,5; вода – 100 см3; нормальный раствор гидроокиси натрия – 16,4 см3.
Среду разливают в пробирки по 9 мл в каждую и стерилизуют при 1 атм. Углеводы и спирты рекомендуется стерилизовать отдельно при давлении 0,5 атм в виде 10 %-ных водных растворов и добавлять после стерилизации к стерильной среде в количестве 1 %. Растворы дисахаридов лучше стерилизовать фильтрованием, чтобы избежать их гидролиза при высокой температуре.
Среды с углеводами и спиртами засевают одновременно 0,1-0,2 мл суспензии клеток изучаемого микроорганизма и ставят в термостат. Если микроорганизм развивается быстро, то результаты можно регистрировать через 48-96 часов, а если медленно – через 7-10 суток.
Визуально по помутнению среды, образованию плёнки, осадка отмечают рост или его отсутствие на всех использованных средах. Рост на средах с этими соединениями может приводить к накоплению органических кислот, нейтральных продуктов и газов. Образование кислот отмечают по изменению рН среды; образование газов – по появлению на поверхности среды пены или в толще среды “глазков”, или по “газовкам” (маленьким пробиркам – ампулам, опускаемым на дно пробирок с жидкой средой и направленным закрытым концом вверх). При рН 6,0 индикатор Андреде жёлтого, а при рН 7,0 синего цвета (соответственно при восстановлении цвет раствора меняется от соломенного до розового – малинового).
Результаты сравнивают с контрольной средой, не содержащей ни углеводов, ни спиртов.
На основании полученных результатов делают заключение о том, какие углеводы и спирты использует изучаемый организм.
Также могут использоваться среды Гисса с индикатором Андреде, полужидкие среды с индикатором “ВР” (водно-голубой краситель, обесцвеченный розоловой кислотой) и различные индикаторы: нейтральный красный, лакмус, фуксин основной и т.д.
Похожие работы
... HAC. 3.1 Изучение морфолого-физиологических и культуральных свойств микроорганизмов Целью данного этапа эксперимента являлось выделение, изучение свойств микроорганизмов и определение их видовой принадлежности. Исследуемые культуры были выделены из сточной воды после эмульсионного обезжиривания меховой овчины. Изучаемые культуры были обозначены номерами 3,7, F, G, I, Iў. Получение чистых культур ...
... Охрана окружающей среды Заключение Рисунок 2 – Сетевой график дипломной работы 2.1 Объекты исследования Объектом исследования в дипломной работе являлись микроорганизмы, выделенные из различных природных жиров: нерпичьего (Н), нерпичьего, выращенного на среде с шёрстным жиром (Нв), шерстного (В) и микроорганизмы, выделенные из ...
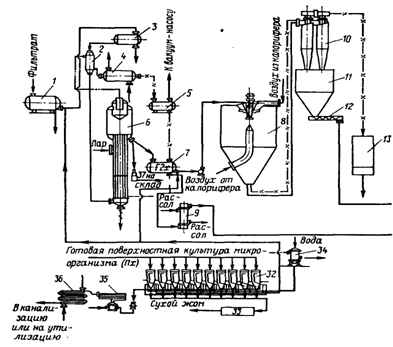
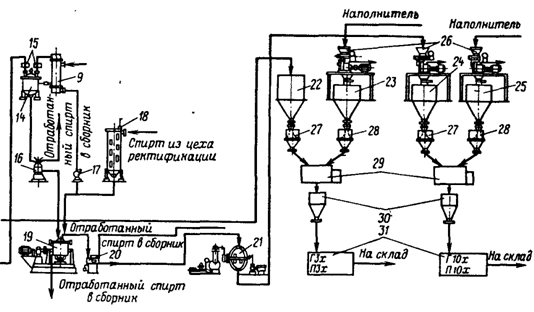
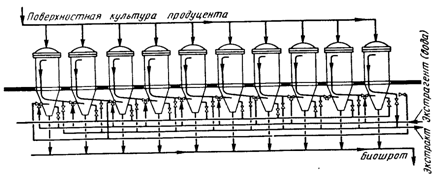
... инактивация ферментов. Из сборника 29 охлажденная жидкость по мере необходимости подается на фильтровальную установку. 1.3 Получение ферментных препаратов из культур микроорганизмов Культура микроорганизмов, выращенная поверхностным способом, и культуральная жидкость после глубинного культивирования содержат большое количество балластных веществ. Выделение и очистка ферментов – трудоёмкий и ...


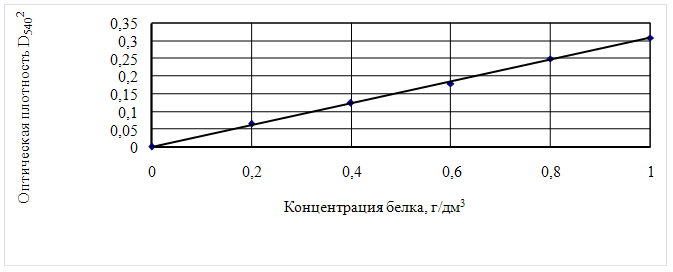
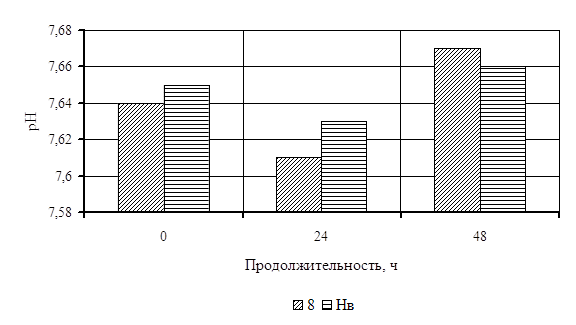
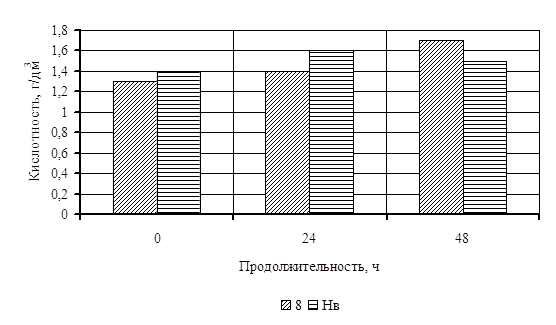
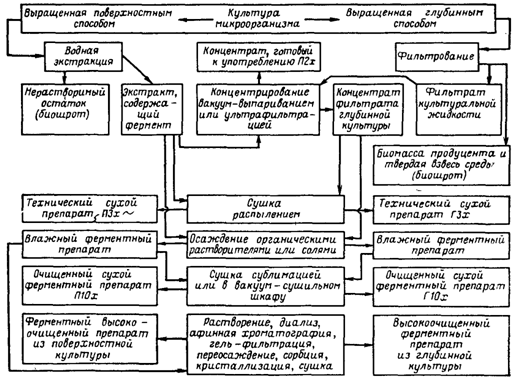
0 комментариев