Навигация
Зависимость скорости реакции от концентрации исходных веществ. Закон действующих масс
1.2 Зависимость скорости реакции от концентрации исходных веществ. Закон действующих масс.
Рассмотрим элементарную бимолекулярную реакцию проходящую в закрытой системе:
А + В -> Продукты.
Для того, чтобы реакция шла молекулы А и В должны сблизиться на достаточно близкое расстояние (столкнуться) и прореагировать.
Доля прореагировавших молекул А и В пропорциональна вероятности их активных столкновений. Эта вероятность, как вероятность сложного события, пропорциональна произведению вероятностей того, что молекулы А и В одновременно окажутся в данной точке реакционного пространства (например, реакционного сосуда). Названые вероятности пропорциональны концентрациям молекул А и В. Следовательно, вероятность одновременного присутствия частиц А и В в одной и той же точке пространства (элементарном объёме) пропорциональна произведению их концентраций.
Из этих рассуждений следует, что скорость элементарной бимолекулярной реакции пропорциональна произведению концентраций веществ А и В, то есть можно записать:
 (7)
(7)
где 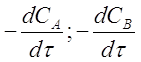 -
-
скорости расходования исходных веществ, которые отрицательны;
К - коэффициент пропорциональности, называемый константой скорости реакции.
Константа скорости химической реакции - это скорость реакции при концентрации исходных веществ равной единице. Иногда эту величину называют удельной скоростью.
Если элементарная бимолекулярная реакция протекает между двумя одинаковыми молекулами, например
2А → Продукты,
то вместо уравнения (7) получим:
W = KCACA=KCA2 (8)
Из уравнений (7) и (8) видно, что скорость элементарных бимолекулярных реакций пропорциональна произведению концентраций реагентов (исходных веществ) в степени равной их стехиометрическим коэффициентам в уравнении реакции. Такая зависимость носит название - закон действующих масс, установленный норвежскими учеными Гульдбергом и Вааге (1864 - 1867 г.).
Для любой элементарной реакции
а1А1 + а2А2 + а3А3 → Продукты
уравнение скорости реакции (закон действующих масс) будет иметь вид:
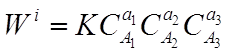
Показатели степени а1 а2 аз - называют порядками реакции по веществам А1 А2, А3.
Сумма 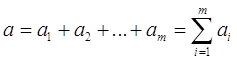 (9)
(9)
- называется общим или суммарным порядком реакции.
Следовательно, порядок реакции равен сумме показателей степеней в уравнении зависимости скорости реакции от концентрации исходных веществ.
Для элементарной реакции он равен сумме (положительных значений) стехиометрических коэффициентов исходных веществ в уравнении реакции (или стадии реакции).
Порядок элементарных реакций не бывает больше трех. Связано это с тем, что порядок реакции отражает в какой-то мере количество частиц участвующих в элементарном акте реакции. Вероятность одновременной встречи четырех частиц практически равна нулю. Поэтому

Зависимость скорости реакции от концентрации реагирующих веществ называется кинетическим уравнением. Для элементарных реакций может быть только шесть типов кинетических уравнений в соответствии с числом видов химических уравнений.
Для сложных химических реакций, состоящих из нескольких элементарных стадий, может быть степенная зависимость скорости реакции от концентрации с показателями степени отличными от стехиометрических:
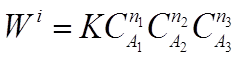
где п1 п2 п3 - порядки реакции по веществам А1 А2 А3. Общий порядок реакции равен:
п = п1+ п2+ п3 .
При этом значения п1 п2 п3 могу быть не равны стехиометрическим коэффициентам, иметь дробные величины и больше трех.
1.3 Молекулярность и порядок реакции
При изучении реакций выделяют молекулярность и порядок реакции.
Молекулярность реакции - это число молекул исходных веществ, принимающих участие в одном (единичном) химическом превращении. При этом число молекул образующихся продуктов не имеет значения.
В соответствии с приведенным определением различают реакции:
1) мономолекулярные, в которых только один вид молекул участвует в превращении, причем стехиометрический коэффициент в уравнении равен единице, например,
запись А → С означает, что молекула вещества А превращается в молекулу вещества С;
2) бимолекулярные, в которых участвуют два различных вида молекул или две молекулы одного вида (стехиометрический коэффициент во втором случае равен двум), например, А + В→С или 2А → С;
3) тримолекулярные, в которых участвуют три молекулы одного или разного видов, например,
А + В + D → С или
2 А + В → С, или 3А→С.
Реакции более высокой молекулярности маловероятны. Связано это с причиной, о которой говорилось ранее.
Выше было сказано, что порядок химической реакции выражается
суммой:
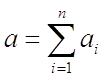
где аi - показатели степени концентрации исходных веществ в уравнении действующих масс.
Они приравнивались стехиометрическим коэффициентам компонентов химической реакции. Исходя из этого можно сделать заключение, что молекулярность и порядок реакции это одинаковые величины. Однако, это не всегда так. Порядок реакции или равен молекулярности или, в большинстве случаев, меньше её. Расхождение между порядком реакции и её молеклярностью может быть вызвано разными причинами.
1. Молекулярность реакции величина теоретическая, а порядок реакции - экспериментальная. Между теоретическими и экспериментальными величинами почти всегда есть различия.
2. Если, например, в реакции
bB + dD = P,
скорость которой W = КСBbCDd
один из компонентов, например, компонент B, находится в избытке, то в ходе данной реакции его концентрация будет изменяться незначительно и в уравнении скорости реакции можно принять СB = const. Но в таком случае скорость реакции практически зависит от концентрации только компонента D, то есть W = К1CDdтогда порядок реакции равен d, а молекулярность реакции (b + d).
3. Если данная реакция является гетерогенной, то в зависимости от условий протекания порядок такой реакции может быть различным.
4. Порядок каталитической реакции также может отличаться от молекулярности, причина - сложный механизм таких реакций.
5. Для сложной реакции, протекающей в несколько стадий, порядок реакции и её молекулярность не совпадают. В данном случае порядок реакции определяет какая-либо промежуточная (лимитирующая) стадия. Как правило порядок этой стадии отличается от молекулярности сложной реакции.
Похожие работы
... ; VCH3OH=10мл; [MA]0: [CO]0: [O2]0 = 5:3:2. Причины этого эффекта будут изучены в ходе дальнейших исследований. 5. Патентный поиск 5.1. Введение Данная дипломная работа посвящена изучению условий возникновения колебательного режима при окислительном карбонилировании алкинов в присутствии палладиевых катализаторов. Этот процесс представляет большой интерес, поскольку в дальнейшем позволит ...
... образом зависят от их микроструктуры. Контроль размера, распределения по размерам и морфологии отдельных зерен или кристаллитов чрезвычайно важен для получения материалов с заданными свойствами. Химические реакции в микроэмульсиях используют как один из возможных путей получения тонкодисперсных частиц. В таблице 1 приведены примеры областей, в которых используется микроэмульсионный метод получения ...
... для реализации системы бюджетирования Консультационной группы "Воронов и Максимов". Статья о проблемах выбора системы бюджетирования - в проекте "УПРАВЛЕНИЕ 3000". Бюджетный автомат Если вы решитесь на автоматизацию системы бюджетирования компании, перед вами сразу встанут вопросы: что выбрать, сколько платить, как внедрять. Примеряйте! О ЧЕМ РЕЧЬ В “Капитале” на стр. 44, 45 мы рассказали ...
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...






0 комментариев