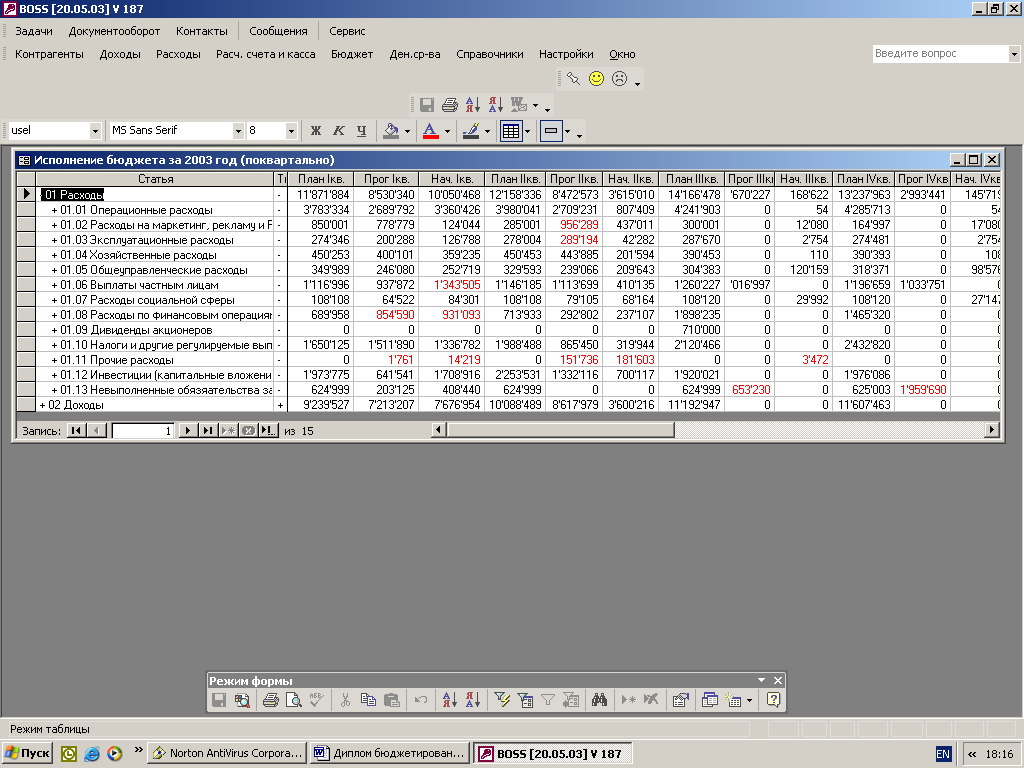
Навигация
Кинетические уравнения химических реакций в закрытых системах
1.4 Кинетические уравнения химических реакций в закрытых системах
Кинетические уравнения представляют зависимость концентрации веществ, участвующих в реакции от времени:
Сi=f(τ).
Получим уравнения для зависимости концентрации исходных веществ от времени для элементарных формально простых реакций первого, второго и третьего порядков. Реакции гомогенные, односторонние (необратимые), протекают в закрытых системах при Т = const и V= const.
1.4.1 Односторонние реакции 1— порядка
Это реакции вида:
А → Продукты.
Выражение для скорости реакции имеет вид:
W = K1C. (10)
Она связана со скоростью расходования исходного вещества А соотношением:

где (- 1) - стехиометрический коэффициент исходного вещества А. Подставляя это выражение в уравнение (10) и опуская для простоты индекс А, получим:
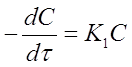 (11)
(11)
Из этого равенства нужно найти в явном виде зависимость концентрации вещества А от времени.
Разделим переменные в уравнении (11):
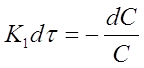
Проинтегрируем полученное уравнение при изменении времени в пределах от 0 до τ и концентрации от 0 до С

и получим
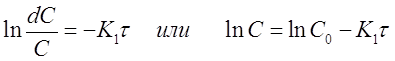 (12)
(12)
Полученная формула позволяет вычислить концентрацию исходного вещества A в любой момент времени протекания реакции при известной концентрации С0 и константе скорости К1, если провести её потенцирование:

где С0 - начальная концентрация исходного вещества А в момент времени τ=0;
С - концентрация этого вещества к моменту времени г,
К1 - константа скорости реакции 1ого порядка. Она имеет размерность - 1/время (с, мин, ч). Индекс 1 означает порядок реакции.
Из уравнения (12) можно получить выражение для вычисления константы скорости реакции 1го порядка:
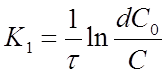 , 1/время.
, 1/время.
Уравнение (12) можно представить несколько в ином виде. Обозначим х - уменьшение концентрации исходного вещества к моменту времени τ, тогда
![]() .
.
Уравнение для константы скорости реакции первого порядка примет вид:
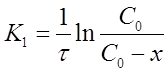 (13)
(13)
Из уравнения (13) при известной константе скорости и начальной концентрации вещества Со можно определить х в момент времени τ. Для этого преобразуем уравнение (13) к виду:
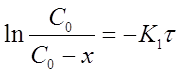
После потенцирования этого выражения получим
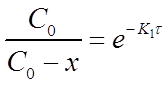
Разрешив уравнение относительно х найдем формулу для его вычисления:
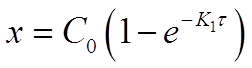
Основной задачей химической кинетики является расчет скоростей химических реакций. Их определяют из уравнения (7) по известной константе скорости. К1 находят экспериментально. При этом по экспериментальным данным изменения концентрации исходного вещества от времени строят график в координатах 1пС - τ. В этой системе координат кинетическое уравнение реакции 1го порядка (12) представляет прямую линию. Тангенс угла наклона этой линии равен К1 (см. рисунок 2).
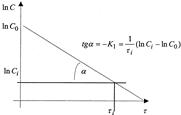
Рисунок 2 - Графическое определение константы скорости реакции 1го порядка
Иногда для характеристики скорости реакции пользуются временем полупревращения или полураспада τ1/2.
τ1/2 - это промежуток времени, в течение которого реагирует
половина взятого вещества: С = 1/2С0; С0 = 2С,
тогда
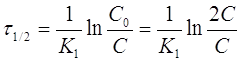
Или
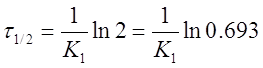
Из уравнения следует, что τ1/2 для реакции первого порядка не зависит от начальной концентрации исходного вещества и определяется только константой скорости.
Уравнения кинетики реакции 1 ого порядка характеризуют не только скорости мономолекулярных реакций, но применимы и к сложным реакциям. Многие сложные реакции протекают как реакции первого порядка.
1.4.2 Односторонние реакции 2го порядка
Это реакции вида:
А1+ А2= Продукты.
Выражение для скорости реакции имеет вид:
W = K2C1C2, (14)
где С1 и С2 - концентрации веществ А1 и А2 в момент времени τ протекания реакции;
К2 - константа скорости реакции 2го порядка. С другой стороны скорость реакции можно представить через изменения концентрации исходных веществ во времени:
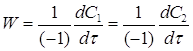 При vi = 1.
При vi = 1.
После подстановки этих соотношений в уравнение (14) получим:
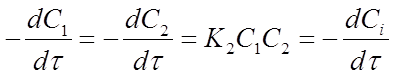 (15)
(15)
Обозначим x - уменьшение концентрации исходных веществ с течением реакции. Тогда
при τ = 0, С1 =С01, С2 =С02;
при τ > 0, С1 = С01 - х , С2= С02 - х ,
где С01 и С02 начальные концентрации веществ A1 и A2, Из равенств для времени τ > 0 в общем виде:
Сi = С0i - х, dСi =-d х.
Подставим приведенные соотношения в уравнение (15) и получим:
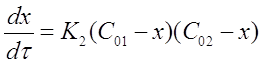
Разделим переменные в полученном выражении и проведем некоторые преобразования:

Окончательно можно записать:
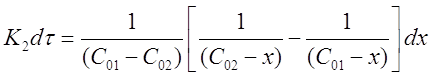
Проинтегрируем выражение в пределах от τ = 0 до τ и от х = 0 до х:
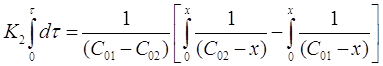
После решения интегральных выражений получим:
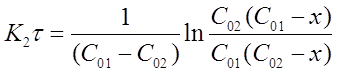
Откуда:
 (16)
(16)
При выводе формулы для расчета К2 использовано вычисление неопределенного интеграла
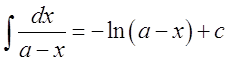
Из уравнения (16), после небольших его преобразований, можно получить выражение для расчета х .
Представим формулу (16) в виде:
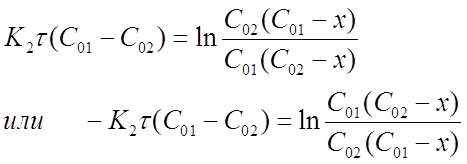
После потенцирования получим

Откуда
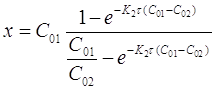
В частном случае, когда С01 = C02 = C0 уравнение скорости односторонней реакции второго порядка примет вид (при v = 1):
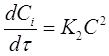 (17)
(17)
Если использовать значение х, то производная:
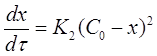 (18)
(18)
Разделим переменные в уравнениях (17) и (18), проинтегрируем первое в пределах от 0 до τ и от С0 до С, второе от 0 до τ и от 0 до х:
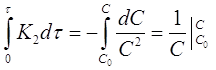
Откуда
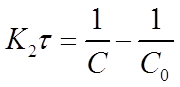 (19)
(19)
Если уравнение разрешить относительно К2, то получим:

Интегрирование уравнения (18)
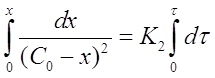
после решения для определения К2 дает формулу:
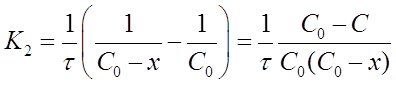
Константу скорости К2 определяют экспериментально. При этом используют уравнения (16) или (19) в виде:
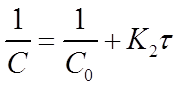
Приведенное уравнение в системе координат (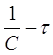 ) дает
) дает
прямую линию. Тангенс угла наклона этой линии, построенной по экспериментальным данным, равен константе скорости изучаемой реакции (рисунок 3).
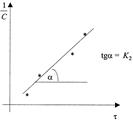
Рисунок 3 - Графическое определение константы скорости реакции второго порядка
1.4.3 Односторонние реакции 3го порядка
Это реакции вида:
3А → Продукты или А1 + А2+ А3 → Продукты.
Для скорости первой реакции справедливо соотношение:
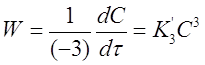
Откуда

Где К3 =3К’3
Если концентрации исходных веществ СА1 =СА2 =СА3=С в любой момент времени, то кинетическое уравнение скорости второй реакции имеет вид:
 (20)
(20)
где K3 = К’3 .
Разделим переменные в уравнении (20) и проинтегрируем его в пределах от 0 до τ и от С0 до С
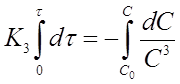
И получим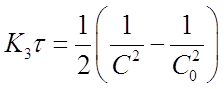
Если это равенство разрешить относительно К3, то найдем формулу для вычисления константы скорости реакции третьего порядка:
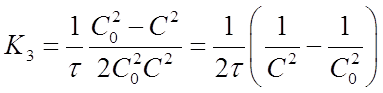 (21)
(21)
где С0 - начальная концентрация исходного вещества;
С - концентрация исходного вещества в момент времени г,
τ- время от начала реакции.
Константу скорости К3 определяют экспериментально. При этом используют уравнение (21) в виде:
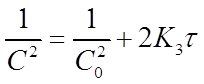
В системе координат (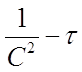 ) это уравнение представляет прямую линию, угловой коэффициент которой (тангенс угла наклона) равен 2К3 (рисунок 4).
) это уравнение представляет прямую линию, угловой коэффициент которой (тангенс угла наклона) равен 2К3 (рисунок 4).
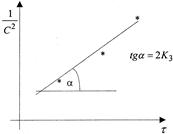
Рисунок 4 - Графическое определение константы скорости реакции третьего порядка
Константа скорости реакции 3го порядка имеет размерность: К3, [1/время конц.2].
Если для реакции третьего порядка использовать величину х, то уравнение для скорости реакции приобретет вид:
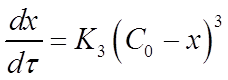
После разделения переменных и интегрирования уравнения в пределах от 0 до х и от 0 до τ можно получить выражение для константы скорости реакции
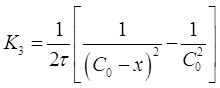
Существуют реакции, в которых скорость процесса не зависит от концентрации, так как она определяется некоторыми другими лимитирующими факторами, например, поглощением света при фотохимических реакциях или скоростью диффузии при поверхностных реакциях. Такие реакции считаются реакциями нулевого порядка. Для них
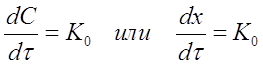 тогда
тогда 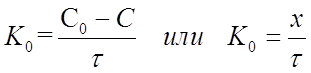
Размерность константы скорости реакции нулевого порядка К0, [время-1 конц.].
Похожие работы
... ; VCH3OH=10мл; [MA]0: [CO]0: [O2]0 = 5:3:2. Причины этого эффекта будут изучены в ходе дальнейших исследований. 5. Патентный поиск 5.1. Введение Данная дипломная работа посвящена изучению условий возникновения колебательного режима при окислительном карбонилировании алкинов в присутствии палладиевых катализаторов. Этот процесс представляет большой интерес, поскольку в дальнейшем позволит ...
... образом зависят от их микроструктуры. Контроль размера, распределения по размерам и морфологии отдельных зерен или кристаллитов чрезвычайно важен для получения материалов с заданными свойствами. Химические реакции в микроэмульсиях используют как один из возможных путей получения тонкодисперсных частиц. В таблице 1 приведены примеры областей, в которых используется микроэмульсионный метод получения ...
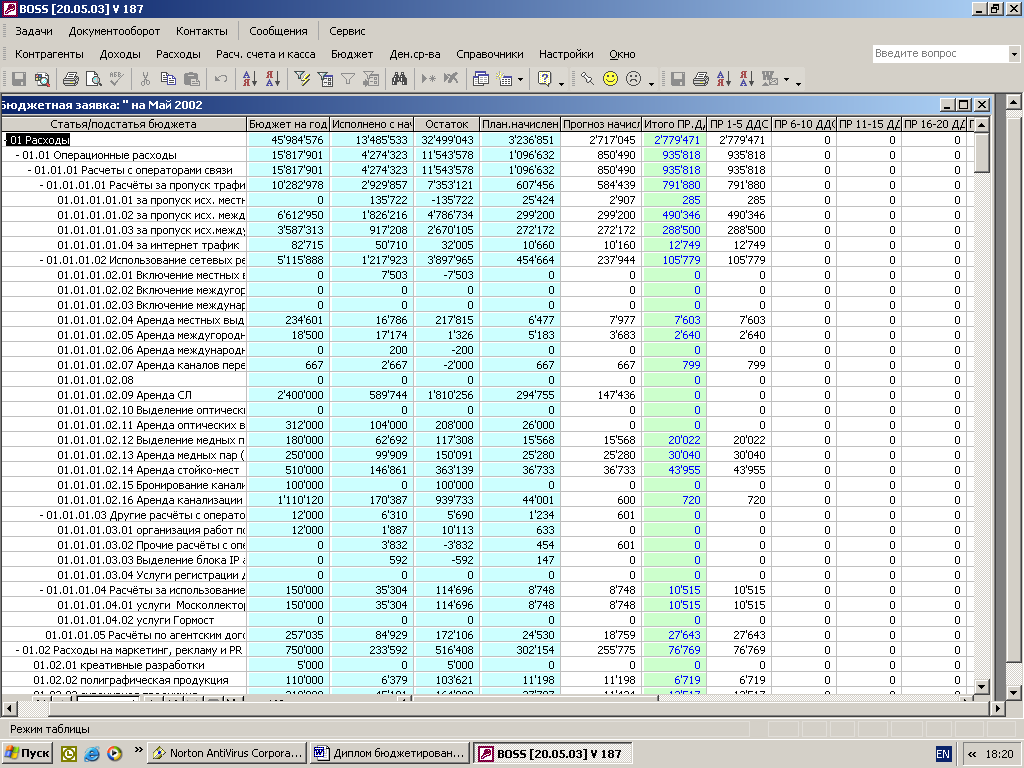
... для реализации системы бюджетирования Консультационной группы "Воронов и Максимов". Статья о проблемах выбора системы бюджетирования - в проекте "УПРАВЛЕНИЕ 3000". Бюджетный автомат Если вы решитесь на автоматизацию системы бюджетирования компании, перед вами сразу встанут вопросы: что выбрать, сколько платить, как внедрять. Примеряйте! О ЧЕМ РЕЧЬ В “Капитале” на стр. 44, 45 мы рассказали ...
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...

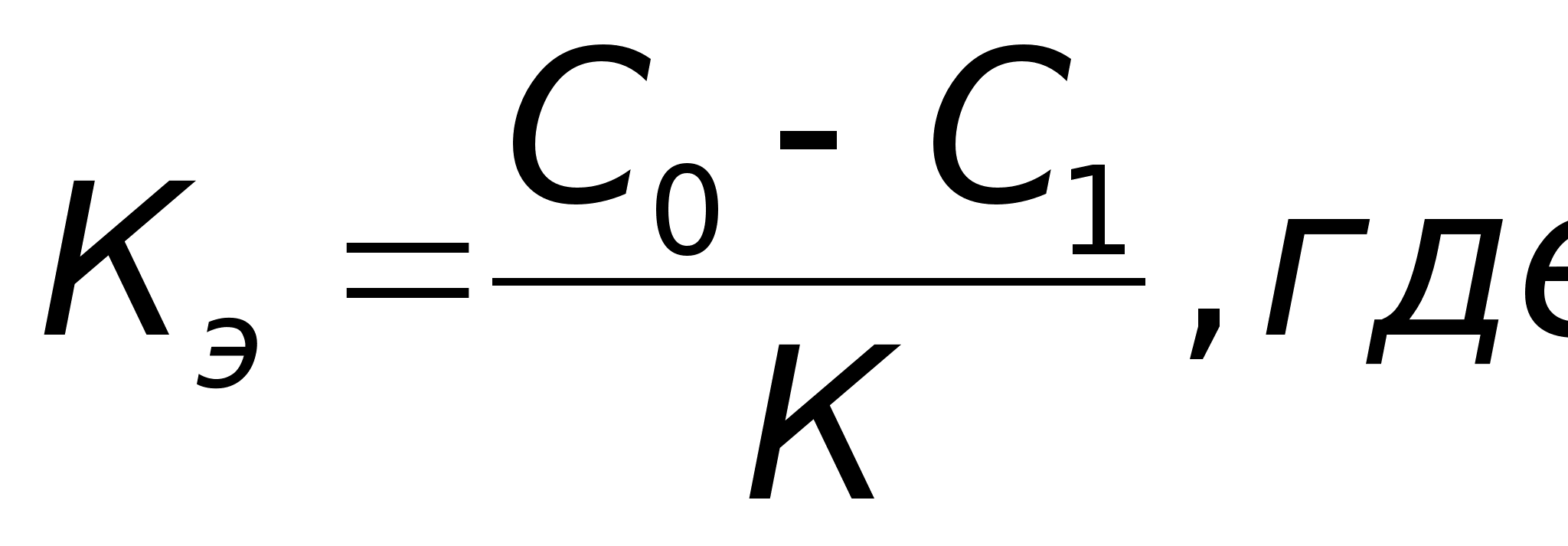
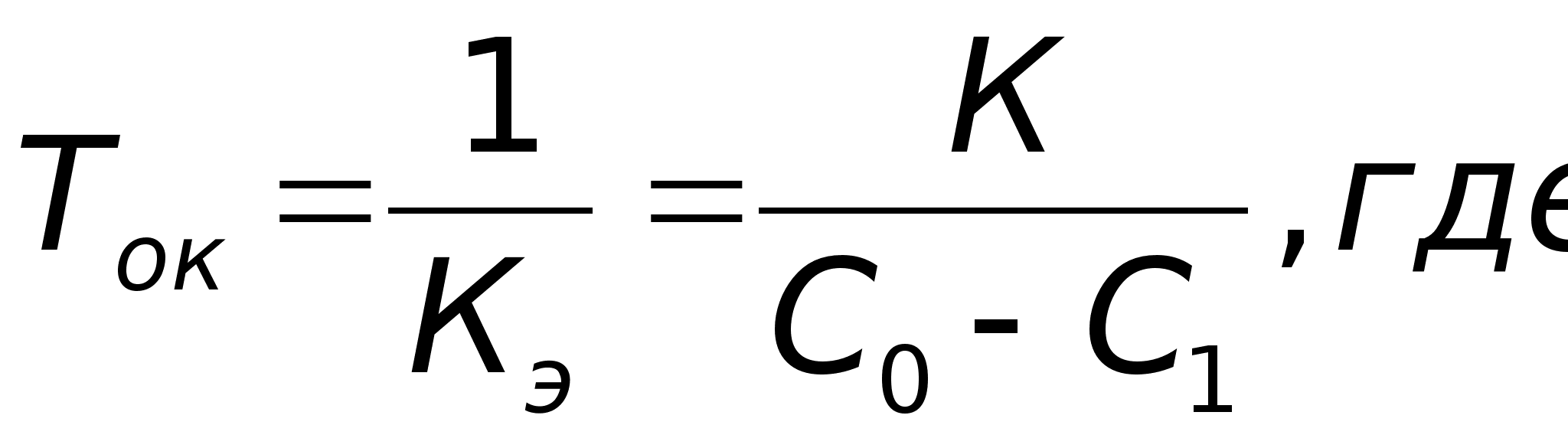
0 комментариев