Навигация
Способы определения порядка реакции и константы скорости
1.5 Способы определения порядка реакции и константы скорости
1.5.1 Способ избыточных концентраций
Для реакции
v1А1 + v2A2→Продукты (22)
зависимость скорости от концентрации исходных веществ записывается уравнением:
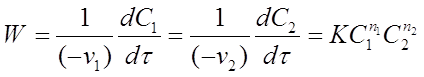 (23)
(23)
где С1 и С2 - концентрации исходных веществ А1 и А2;
п1 и п2 - порядки реакции по веществам А1 и А2;
К - константа скорости реакции. Общий (суммарный) порядок реакции равен:
п = п1 + п2 (24)
Если реакция элементарная и формально простая и подчиняется кинетическому уравнению для элементарных реакций, то порядок реакции по веществам А1 и А2 равен их стехиометрическим коэффициентам в уравнении реакции, то есть
п1=v1 и п2=v2
тогда п = v1+ v2
Для определения порядка химической реакции сначала, по экспериментальным результатам изменения концентрации исходных веществ со временем, находят порядки реакции по веществам. Затем общий порядок реакции.
Для того чтобы скорость реакции зависела в явном виде только от концентрации одного из исходных веществ, обычно используют способ избыточных концентраций или метод изолирования Оствальда.
Он заключается в следующем.
Сначала проводят реакцию, когда концентрация исходного вещества А2 избыточна по сравнению с веществом А1. При протекании реакции считают, что меняется только концентрация вещества А1 (обычно она в 10...1000 раз меньше концентрации остальных веществ), а концентрация вещества А2 практически постоянна и её можно ввести в постоянный коэффициент. При этом уравнение (23) примет вид:
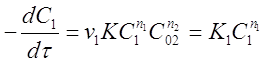 (25)
(25)
где 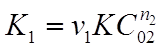 - константа скорости реакции по веществу А1.
- константа скорости реакции по веществу А1.
Затем проводят реакцию при избытке вещества А1 по сравнению с веществом А2. Тогда уравнение (23) преобразуется к виду:
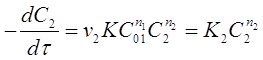 (26)
(26)
где ![]() - константа скорости реакции по веществу А2.
- константа скорости реакции по веществу А2.
Если удастся определить величины п1 и п2 , то можно будет найти общий порядок реакции по формуле (24) и константы скорости К1 и К2 , а затем константу скорости реакции по формуле:
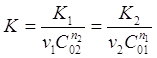
Иногда при проведении опытов используют метод, в котором концентрацию одного из исходных веществ изменяют, а концентрацию другого вещества оставляют постоянной.
Способы расчета порядка реакции по данному веществу подразделяются на дифференциальные и интегральные. Рассмотрим некоторые из них.
1.5.2 Дифференциальный метод (метод Вант-Гоффа)
При расчетах этим способом используют опытные данные зависимости скорости реакции от времени (кинетическое уравнение):
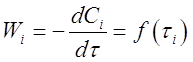
Из опытов, как правило, получают зависимость концентрации данного компонента от времени (кинетическую кривую) Ci= f(τi) .
Поэтому для определения скорости реакции строят график в координатах
Ci- τi (рисунок 5). Скорость реакции в заданные моменты времени τi находят проведением касательных к экспериментальной кривой по величине тангенса угла наклона этих касательных (графическим дифференцированием):
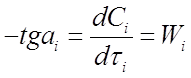
По уравнению (25) находят К1, п1 или К2, п2 по уравнению (26).
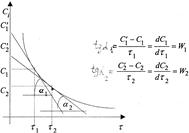
Рисунок 5 - Графическое определение скорости реакции по кинетической кривой
В данном случае можно использовать так называемый способ логарифмирования.
Рассмотрим сначала исходные формулы.
Пусть зависимость скорости реакции (22) по первому исходному веществу А1 выражается уравнением (при условии, что остальные вещества в избытке):

где п1 - порядок реакции по первому веществу.
Прологарифмируем полученное выражение:
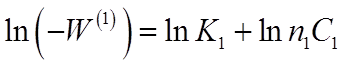 (28)
(28)
Так как скорость реакции по исходному веществу является отрицательной величиной, то значение 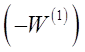 положительно. На графике в координатах
положительно. На графике в координатах 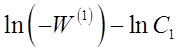 опытные точки для разных моментов времени, в случае справедливости уравнения (28) должны расположиться на прямой линии (рисунок 6). Отрезок на оси ординат дает значение lnК1, а тангенс угла наклона а прямой линии равен порядку п1 по первому веществу.
опытные точки для разных моментов времени, в случае справедливости уравнения (28) должны расположиться на прямой линии (рисунок 6). Отрезок на оси ординат дает значение lnК1, а тангенс угла наклона а прямой линии равен порядку п1 по первому веществу.
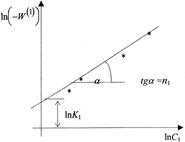
Рисунок 6 - Графическое определение порядка реакции по веществу
Скорость изменения концентрации вещества определяется непосредственно из эксперимента или из кинетической кривой (рисунок 5).
Есть и другие дифференциальные способы. Их достоинство -простота. Недостаток - большая погрешность в определении tga из
графика. Более точные результаты дают интегральные способы.
1.5.3 Интегральные способы
В этих способах используют выражения для зависимости концентрации веществ от времени (уравнения кинетических кривых), полученные после интегрирования уравнений вида:
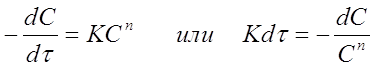 (29)
(29)
Рассмотрим некоторые интегральные способы.
1. Способ подстановки
Проинтегрируем уравнение (29) в пределах от 0 до τ и от С0 до С при п = 1, 2, 3, при этом получим:
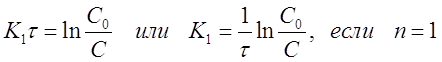 (30)
(30)
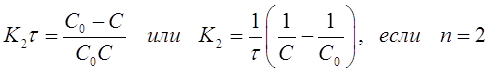 (31)
(31)
 (32)
(32)
где C0 - начальная концентрация исходного вещества.
Подстановкой в эти уравнения опытных значений концентраций С исследуемого вещества, в разные моменты времени протекания реакции, вычисляют значения К. Если расчетные К, например, по уравнению (31) остаются постоянными, то это означает, что порядок реакции по веществу равен двум.
В способе подстановки для реакций 2го порядка, когда концентрации исходных веществ неравны можно использовать формулу (16).
2. Графический способ
Перепишем уравнения (30)...(32) в виде:
![]()
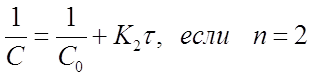
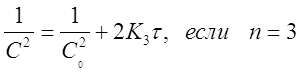
Из уравнений видно, что график, построенный по опытным данным для концентраций рассматриваемого вещества, в разные моменты времени протекания реакции, будет выражаться прямой линией в разных координатах в зависимости от порядка данной реакции по веществу. А именно:
при п=1 в координатах ln C-τ
при п = 2 в координатах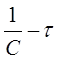
при п=3 в координатах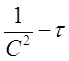
Например, если график, построенный по экспериментальным данным в координатах (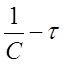 ) прямая линия, то это означает, что исследуемая реакция 2го порядка.
) прямая линия, то это означает, что исследуемая реакция 2го порядка.
Похожие работы
... ; VCH3OH=10мл; [MA]0: [CO]0: [O2]0 = 5:3:2. Причины этого эффекта будут изучены в ходе дальнейших исследований. 5. Патентный поиск 5.1. Введение Данная дипломная работа посвящена изучению условий возникновения колебательного режима при окислительном карбонилировании алкинов в присутствии палладиевых катализаторов. Этот процесс представляет большой интерес, поскольку в дальнейшем позволит ...
... образом зависят от их микроструктуры. Контроль размера, распределения по размерам и морфологии отдельных зерен или кристаллитов чрезвычайно важен для получения материалов с заданными свойствами. Химические реакции в микроэмульсиях используют как один из возможных путей получения тонкодисперсных частиц. В таблице 1 приведены примеры областей, в которых используется микроэмульсионный метод получения ...
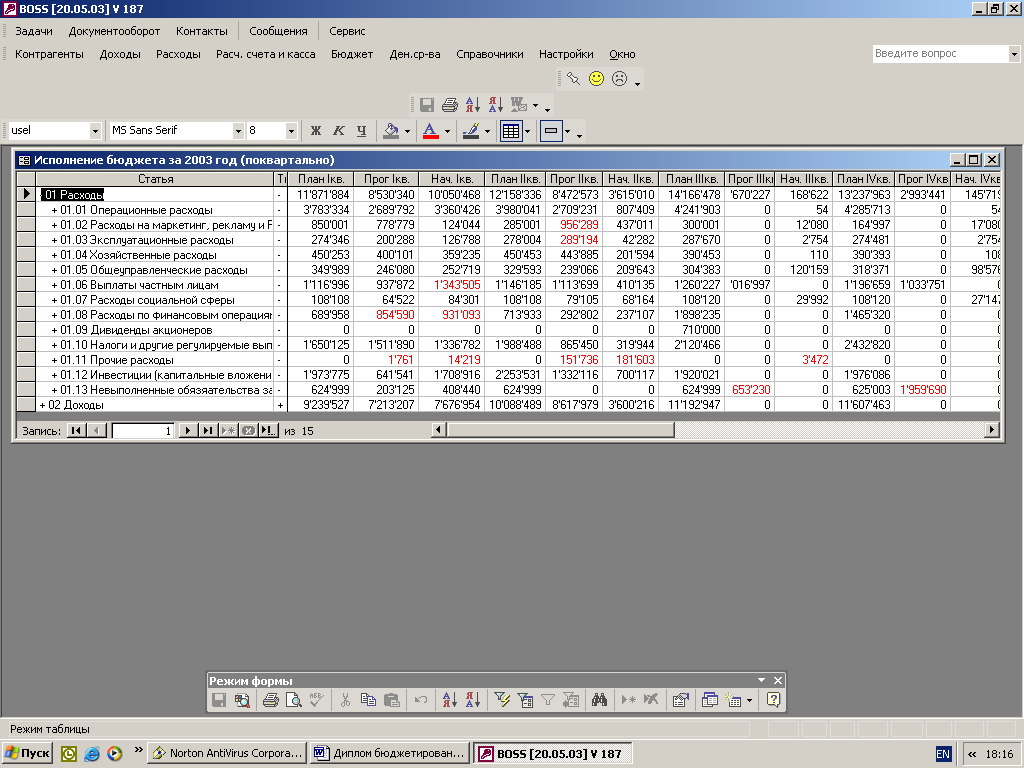
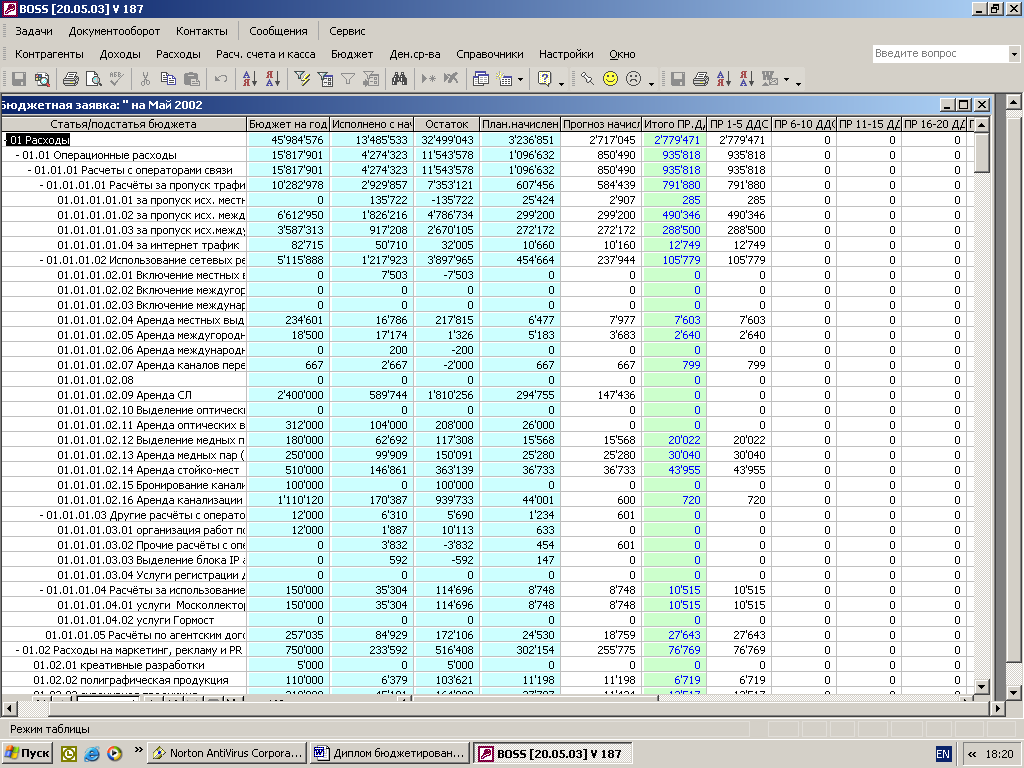
... для реализации системы бюджетирования Консультационной группы "Воронов и Максимов". Статья о проблемах выбора системы бюджетирования - в проекте "УПРАВЛЕНИЕ 3000". Бюджетный автомат Если вы решитесь на автоматизацию системы бюджетирования компании, перед вами сразу встанут вопросы: что выбрать, сколько платить, как внедрять. Примеряйте! О ЧЕМ РЕЧЬ В “Капитале” на стр. 44, 45 мы рассказали ...
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...

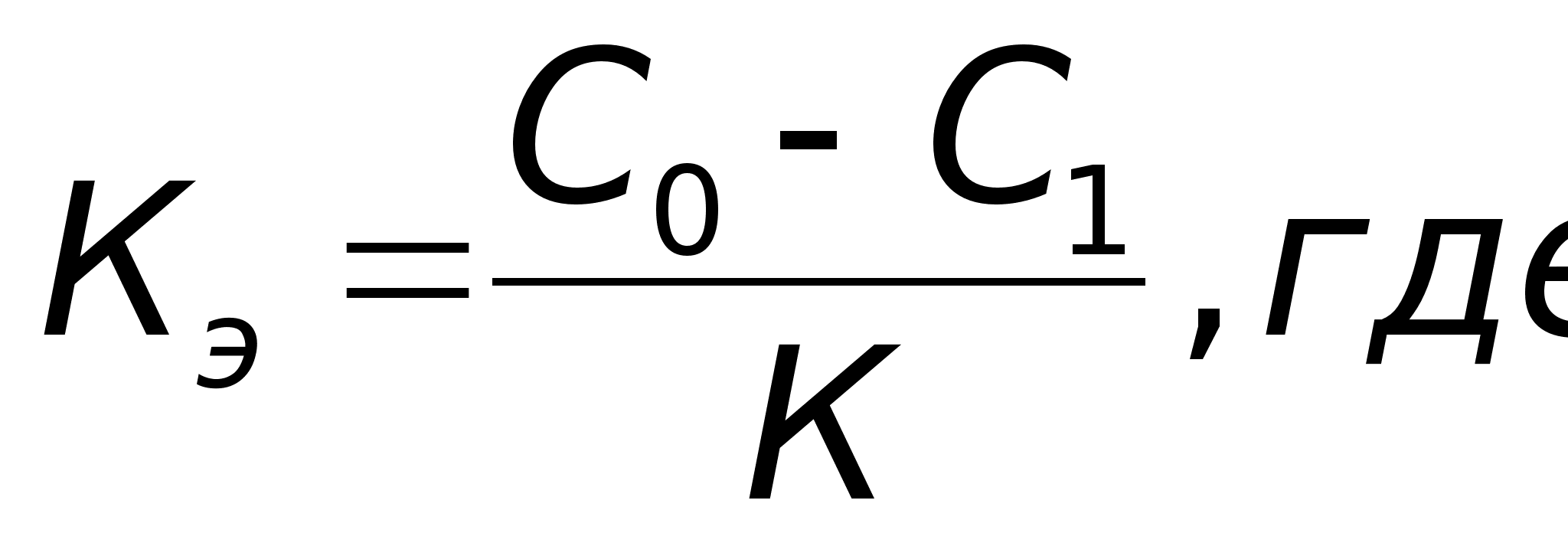
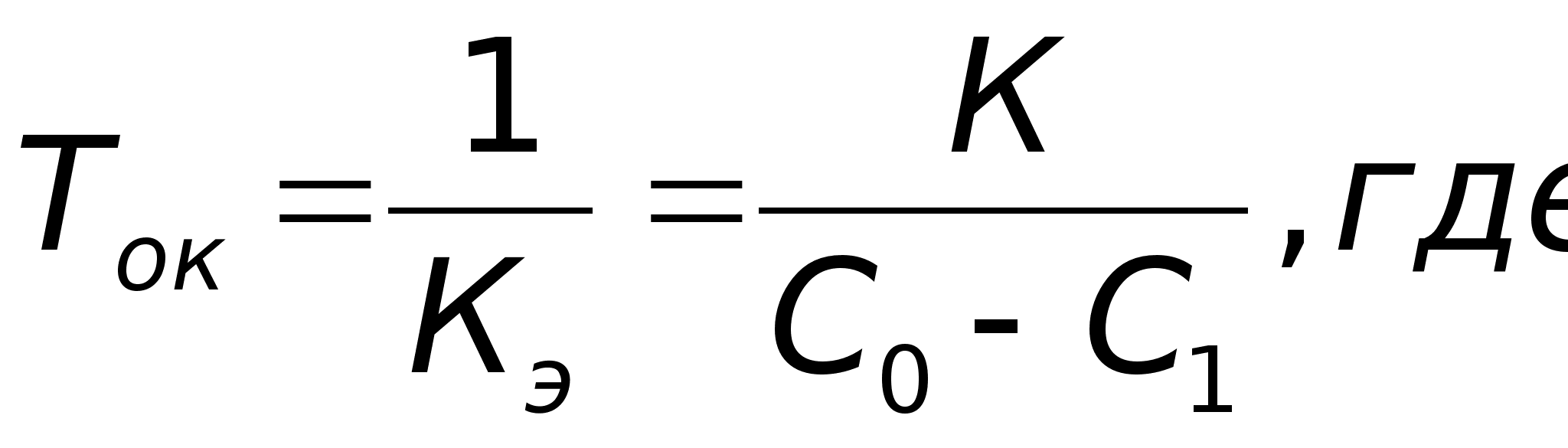





0 комментариев