Навигация
Химия и технология платиновых металлов
Буслаева Татьяна Максимовна
Химия и технология платиновых металлов
(Лекционный курс)
Москва – 1999 г.
Введение
Платиновые металлы – это элементы VIII группы Периодической системы Д.И. Менделеева. Их шесть: в пятом большом периоде – так называемые «легкие» платиновые металлы – рутений (Ru), родий (Rh), палладий (Pd) с порядковыми номерами, соответственно, 44, 45, 46 и в шестом – «тяжелые» осмий (Os), иридий (1г), платина (Pt), имеющие порядковые номера 76, 77, 78. Вместе с золотом и серебром металлы платиновой группы образуют семейство благородных металлов – благородных потому, что они отличаются низкой химической активностью, высокой коррозионной стойкостью, а изделия из них имеют красивый, благородный, внешний вид.
Платина (от исп. «plata» – серебро) – элемент, давший название всей рассматриваемой группе металлов. Она известна человечеству с незапамятных времен: следы платины обнаруживаются еще в древнеегипетских инкрустациях. Однако первое упоминание о платине в архивах относится к 1735 г., а первое описание выполнено испанским офицером, физиком и математиком Доном Антонио де Ульоа в 1748 г. К этому же периоду относится начало исследований доставленных из Южной Америки, с территории нынешней Колумбии, в Европу образцов платиновой руды («сырой» платины) и попытки получения ковкого металла. Например, в те годы уже была обнаружена способность платины растворяться в «царской водке». В 1803–1804 гг. англичанин В.Х. Волластон обнаружил в указанном растворе следующие два металла платиновой группы: палладий (в честь астероида Паллас) и родий («rodon» – розовый, соли родия имеют розовую окраску). Из нерастворимого остатка после растворения «сырой» платины в «царской водке» другой английский исследователь С. Теннант выделил еще два платиновых металла: иридий («iridios» – радуга) и осмий («osmh» – запах, летучий оксид осмия имеет неприятный запах).
И, наконец, в 1844 г. был открыт последний из элементов платиновой группы – рутений (лат. «Ruthenia» – Россия). Автор этого открытия – профессор химии Казанского университета Карл Карлович Клаус. Открытие этого элемента именно в России во многом было предопределено тем обстоятельством, что двумя десятилетиями ранее на Урале были разведаны богатейшие залежи самородной платины, и к 1835 г. Россия уже чеканила платиновые монеты. Это свидетельствовало о высоком (для того времени) уровне развития хи-мической науки и инженерной мысли.
Содержание платиновых металлов в земной коре (кларк) оценивается, по данным разных авторов, на уровне 10-6 – 10-9%% для палладия и 10-6 – 10-11%% – для остальных платиновых металлов. Собственно минералы платиновых металлов не образуют месторождений, перспективных для промышленной переработки. Минералы платины и палладия преимущественно вкраплены в основные рудообразующие сульфидные минералы меди, никеля, железа – халькопирит, пентландит, пирротин и др. Рутений, родий, осмий и иридий, которые называются редкими платиновыми металлами, как правило, замещают атомы цветных металлов и железа в кристаллических решетках их минералов. Таким образом, платиновые металлы являются не только редкими, но и рассеянными элементами.
По запасам платиновых металлов, которые оцениваются суммарно в 56 тыс. тонн, Россия занимает второе после Южно-Африканской республики место в мире. Главным источником платиновых металлов в России являются сульфидные медно-никелевые руды полуострова Талнах.
При переработке медно-никелевых руд металлы платиновой группы следуют за никелем и медью по всем технологическим цепочкам, концентрируясь в черновом (неочищенном) никеле и черновой меди. Если в исходной руде содержание платиновых металлов колеблется от десятых долей грамма до нескольких граммов, то в черновом никеле, например, ориентировочно присутствует 350 г./т платины и 750 г./т палладия. На заключительном этапе – в процессе электролиза чернового металла (он является катодом) – платиновые металлы, а также золото и серебро оседают на дно электролизной ванны в виде шлама. Именно электролитные шламы служат непосредственным источником платиновых металлов. Из них получают богатые платиновые концентраты, а затем в процессе аффинажа и сами металлы.
Наряду с первичным, перерабатываются также различные виды вторичного (отработанные катализаторы, электронный лом, отходы фото- и кинопленки, бракованные изделия и т.п.) и техногенного (шлаки, кеки, пыли) сырья. Их доля в общем объеме перерабатываемого сырья неуклонно возрастает.
Производство платиновых металлов измеряется в тройских унциях (1 тр. унция = 31.1 г.), а цены – в долларах за тройскую унцию. Следует отметить, что независимо от абсолютного значения цены, платина всегда дороже золота. Самый дешевый из металлов платиновой группы – рутений (для сравнения: в 1996 г. при цене на платину порядка 400 долл. за тр. унцию, рутений стоил не более 1 долл./тр. унцию).
Металлы платиновой группы сочетают в себе самые разные свойства: термостойкость и пластичность, коррозионную устойчивость и свариваемость, отражательную и эмиссионную способность, тепло- и электропроводность и высокие магнитные характеристики. Некоторые из них отражены в табл. 1. Уникальными физическими и химическими свойствами обладают не только сами металлы, но и их соединения и материалы на их основе: сплавы, катализаторы, порошки, покрытия, оксидные пленки и др. Они играют важную роль в самых разных отраслях промышленности, в химии, анализе, катализе, биологии, медицине; незаменимы в электронике, радио» и электротехнике, химической и нефтеперерабатывающей отраслях, приборостроении, атомной и ракетной технике. Платиновые металлы обеспечивают гарантированно надежную работу вычислительных, измерительных, контролирующих приборов и устройств. Эффект от использования платиновых металлов, которые окружают нас буквально повсюду, переоценить практически невозможно. Платиновые металлы образуют валютный фонд государств.
Одним из наиболее удивительных свойств платиновых металлов является их способность катализировать различные химические процессы: гидрирования и дегидрирования, полимеризации и изомеризации, окисления и восстановления. Именно платине обязано своим появлением само введенное Берцелиусом понятие «катализ». С их участием организованы крупнотоннажные производства. Например, в производстве азотной кислоты на стадии окисления аммиака катализатором служит сетка из сплава платины и 5–10% родия; производство уксусной кислоты взаимодействием метилового спирта с оксидом углерода (реакция карбонилирования) осуществляется в присутствии карбонильного комплекса родия. Нет ни одного платинового металла, который не «сказал» бы своего веского слова в катализе. Потенциального использования ждут сотни каталитически активных комплексов Ru, Os, Ir, Rh.
Однако, пожалуй, самым ярким примером использования каталитических свойств металлов платиновой группы служит процесс очистки, или дожигания, выхлопных газов автомобилей. Наиболее эффективны трехфункциональные катализаторы, платино-палладиево-родиевые, которые позволяют одновременно устранить три токсичных компонента выхлопных газов: углеводороды, оксид углерода, оксид азота. При сжигании 1 тонны горючего, наряду с 40–50 кг СО и 0.3–5 кг NHз и углеводородов, выделяется от 12 до 24 кг оксидов азота. Реакции, приводящие к восстановлению оксидов азота, катализируются родием. Содержание родия в расчете на один фильтр для очистки выхлопов составляет 0.34 г. В настоящее время основная доля производимого родия расходуется в производстве автомобильных катализаторов: при общем объеме выпуска родия в 1995 г. в количестве 459 тыс. тр. унций, 450 – пошло на получение автомобильных катализаторов.
Открытие металлической проиводимости диоксида рутения RuO2 в 1962 г., поистине революционное, послужило толчком для проведения широкого круга исследований электрических свойств простых и смешанных оксидов элементов платиновой группы, а открытая позднее советскими учеными Н.М. Жаворонковым, В.Б. Лазаревым и И.С. Шаплыгиным корреляция между электронной конфигурацией и типом проводимости позволила осуществлять направленный синтез оксидных материалов с заданными свойствами. Без резистивных паст на основе оксидов рутения, которые нашли применение в тонкопленочных и толстопленочных гибридных интегральных схемах, прогресс электронной техники был бы просто немыслим.
Аналогичное явление произошло и с палладием. До 50‑х годов он применялся преимущественно как ювелирный металл (наряду с золотом, серебром и платиной) и компонент стоматологических сплавов. Далее началась новая эра в его использовании – в качестве проводящих паст на основе палладиевых и палладий-серебряных порошков, которые образуют токопроводящие дорожки электронных схем и внутренние электродные слои, а также выводы конденсаторов. На эти цели расходуется в наши дни без малого половина производимого палладия.
Соединения платиновых металлов обладают антимикробной и антивирусной активностью, а также антиканцерогенными свойствами. Комплекс дихлородиамминоплатина(II) цис-строения – [Pt(NH3)2Сl2] (цис-ДДП) внедрен в клиническую практику как эффективный препарат в химиотерапии рака. Разработки, выполненные в Московской государственной академии тонкой химической технологии им. М.В. Ломоносова, позволили предложить один из комплексов палладия(II) с гексаметилентетрамином (уротропином) для лечения особо опасных патогенных субвирусов – прионов, этой новой «чумы», надвигающейся на человечество.
Платиновые металлы имеют и общие сферы применения, и присущие лишь отдельно взятым металлам. Так, в химической промышленности, в электронике, электротехнике используются почти все металлы платиновой группы. В то же время никакие другие металлы не могут заменить иридий в производстве тиглей – контейнеров для получения лазерных и других кристаллических материалов. Иридий выдерживает чрезвычайно высокие температуры (табл. 1), которые требует процесс выращивания кристаллов; его применение исключает коррозию, способную загрязнить драгоценный расплав.
Самый редкий платиновый металл – осмий. Он производится ежегодно в крайне малых – килограммовых – количествах и расходуется преимущественно на выпуск сверхтвердых специальных сплавов, отличающихся повышенной стойкостью к истиранию, для производства компасных игл, осей, трущихся частей точных инструментов и, наконец, шариковых ручек. Классической областью применения осмия в виде тетраоксида OsO4 стала гистология, наука о тканях многоклеточных животных и человека, благодаря способности этого соединения при контактах с биологической тканью восстанавливаться на различных функциональных узлах клеток и окрашивать ее.
Таким образом, возможности платиновых металлов безграничны и неисчерпаемы.
1. Физические свойства платиновых металлов
Платиновые металлы в чистом виде представляют собой порошки различных оттенков серого цвета (порошок осмия – голубоватый). В компактном состоянии рутений – белый металл со слабым голубоватым отливом; родий – серебристо-белый; палладий – белый со слабосероватым отливом; осмий – голубовато-серый; иридий – белый; платина – белого цвета со слабым серым отливом. Представляет интерес система сплавов палладий-индий. Исходные компоненты этой системы – металлы белого цвета. сплавы же в зависимости от состава имеют окраску от лимонно-желтой до цвета червонного золота и розово-сиреневой.
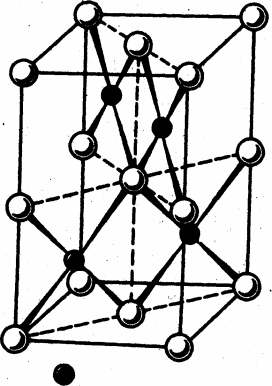
Платиновые металлы тугоплавки и труднолетучи (табл. 1). Платина, палладий, родий, иридий кристаллизуются в гранецентрированной кубической решетке. Кристаллические решетки осмия и рутения – гексагональные с плотнейшей упаковкой. Температуры плавления и кипения металлов в триадах убывают слева направо – от рутения к палладию и от осмия к платине, и снизу вверх по вертикали в Периодической системе (табл. 1). Температуры плавления большинства платиновых металлов значительно превышают 1500 °С. Наиболее тугоплавки осмий и рутений, самый легкоплавкий – палладий. Самые тяжелые металлы (среди платиноидов и вообще всех элементов Периодической системы Д.И. Менделеева) – иридий и осмий.
Среди переходных металлов платиновые имеют наиболее низкое значение величины удельного электросопротивления (табл. 1). В небольших интервалах температурная зависимость электросопротивления близка к линейной, однако в области высоких температур характерно существенное отклонение от линейной зависимости.
Все платиновые металлы являются парамагнетиками. Их магнитная восприимчивость при комнатной температуре изменяется в достаточно широком интервале, причем наименьшую магнитную восприимчивость (0.0690·10-9 м3/кг) имеет осмий, наибольшую (5.231·10-9 м3/кг) – палладий. Чистый палладий – почти ферромагнитный металл с очень высокой магнитной восприимчивостью и легкой поляризуемостью или намагничиванием. Восприимчивость рутения, осмия, родия и иридия монотонно растет с увеличением температуры.
Основными оптическими особенностями металлов платиновой группы являются большая отражательная способность в широком спектральном интервале (металлический блеск) и большой коэффициент поглощения, которые обусловлены наличием большого числа свободных электронов. Наиболее высоким коэффициентом отражения в видимой области обладает родий (от 68 до 98% в зависимости от длины волны). Отражательная способность платиновых металлов имеет практическое значение. Высокая коррозионная стойкость и отсутствие пленок на поверхности обусловливает стабильность отражения и обеспечивает широкое применение родия и палладия в качестве технических зеркал.
Таблица 1. Свойства платиновых металлов| Свойство | Ru | Rh | Pd | Os | Ir | Pt |
| Атомная масса | 101.07 | 102.9 | 106.4 | 190.2 | 192.22 | 195.09 |
| Атомный объем, см3/моль | 8.177 | 8.286 | 8.859 | 8.419 | 8.516 | 9.085 |
| Электронная конфигурация | 4d75s1 | 4d85s1 | 4d105s1 | 5d66s2 | 5d76s2 | 5d96s1 |
| Характерные степени окисления | +3, +4 | +3 | +2 | +4, +6 | +3, +4 | +2, +4 |
| Ионный радиус, нм | 0.062 | 0.065 | 0.064 | 0.065 | 0.065 | 0.064 |
| Первый потенциал ионизации, В | 7.364 | 7.46 | 8.33 | 8.7 | 9.0 | 9.0 |
| Тип кристаллической решетки | г.п.у.[1] | г.ц.к.[2] | г.ц.к. | г.п.у. | г.ц.к. | г.ц.к. |
| Плотность при 20°С, г/см3 | 12.45 | 12.41 | 12.02 | 22.61 | 22.65 | 21.45 |
| Температура плавления, °С | 2334 | 1960 | 1554 | 3050 | 2447 | 1769 |
| Температура кипения, °С | 4080 | 3700 | 2900 | 5020 | 4500 | 3800 |
| Нормальный окислительный потенциал по отношению к потенциалу нормального водородного электрода при 25°С | +0.45 | +0.8 | +0.987 | +0.85 | +1.15 | +1.2 |
| Удельное электросопротивление при 300К, мкОм·см | 7.55 | 5.01 | 10.804 | 10.59 | 5.33 | 10.81 |
| Упругие свойства при 300К, ГПа | 485 | 386 | 124 | 570 | 538 | 173 |
Прочностные характеристики – твердость, временное сопротивление, предел текучести, относительное удлинение, сужение – являются наиболее распространенными и широко применяемыми на практике характеристиками свойств металлов. Осмий, рутений, иридий и родий – очень тверды и хрупки. Наибольшей твердостью обладает осмий, хотя и он может быть растерт в порошок. Палладий и платина обладают самыми низкими упругими характеристиками (табл. 1), сравнительно низкими твердостью и временным сопротивлением. Эти металлы легко деформируются, они очень пластичны и могут подвергаться горячей или холодной обработке; их можно расплющить до тонкой фольги. Платину можно вытянуть в проволоку диаметром 0.0013 мм. Особенно легко обрабатывается механически мягкий и пластичный палладий. Рсдий и иридий более тверды и хрупки, чем платина и палладий. Металлический родий можно прокатать в полосу или проковать в проволоку диаметром до 1 мм. Иридий поддается обработке лишь при температуре 600–750 оС. Обычно рутений с трудом поддается обработке, но при 1050–1250 °С его можно прокатать в полоски толщиной 0.5 мм, а затем при комнатной температуре – до толщины 0.08 мм. Осмий не поддается механической обработке. Меньшая пластичность рутения и осмия, вероятно, обусловливается гексагональной решеткой и примесями. С повышением температуры повышается пластичность всех металлов.
Отличительной особенностью платиновых металлов является их способность адсорбировать на поверхности некоторые газы, особенно водород и кислород. Склонность к адсорбции значительно возрастает у металлов, находящихся в тонкодисперспом и коллоидном состояниях. Вследствие способности к абсорбции газов металлы платиновой группы, главным образом палладий, платина, рутений, применяются в качестве катализаторов при реакциях гидрогенизации и окисления. Каталитическая активность их увеличивается при использовании черни.
Наибольшая способность к адсорбции водорода присуща палладию: один объем палладия в состоянии адсорбировать при комнатной температуре свыше 1000 объемов водорода. Предварительно адсорбированные пары воды увеличивают адсорбцию палладием газов. С повышением температуры растворимость водорода в палладии, в отличие от растворимости в других металлах, быстро понижается.
Водород и дейтерий способны диффундировать через нагретую толстую палладиевую перегородку. Это специфическое свойство палладия, используемое для получения сверхчистого водорода.
В незначительных количествах водород растворяется во всех платиновых металлах. Платина быстро адсорбирует водород. В нагретом состоянии платина обладает высокой проницаемостью по отношению к водороду, причем скорость диффузии и растворимость водорода значительно увеличиваются с увеличением температуры. Однако растворимость водорода в платине даже при высоких температурах мала. Адсорбированный водород может быть удален при нагревании до 100 °С в вакууме. Легче всего он удаляется из палладия, труднее – из платины и особенно трудно из иридия.
Платиновая чернь довольно сильно поглощает кислород: 100 объемов кислорода на 1 объем платиновой черни. Палладий и другие металлы поглощают кислород значительно меньше.
Платиновые металлы имеют различную стойкость к окислению кислородом воздуха, но у всех их она уменьшается с увеличением температуры. При нагревании на воздухе до 1000 °С платина практически не окисляется. Сравнительно легко окисляются осмий, рутений, иридий; осмий в порошке окисляется при комнатной температуре. Скорость окисления платиновых металлов зависит от температуры, давления, состояния окисляющей атмосферы. Убыль массы металла на воздухе обусловлена преимущественно образованием летучих оксидов. Скорость возгонки осмия максимальна, далее следует рутений, иридий, платина, родий и палладий.
Рутений начинает заметно окисляться при 400 °С с образованием RuO2. При ~800 °С RuO2 взаимодействует с кислородом с образованием летучих RuO3 и RuO4. Родий при температуре 1200–1400 ОС образует оксид RhO2, который может существовать как в твердом, так и в газообразном состоянии. При увеличении температуры упругость паров RhO2 возрастает. Палладий образует оксид PdO, который можно визуально наблюдать уже после температуры 350 оС, при 850 оС он разлагается. Осмий при высоких температурах образует газообразные OsO3 и 0sO4. Иридий образует твердый оксид IrO2, устойчивый до 1100 °С. На поверхности платины всегда существует адсорбированный слой кислорода. При повышении температуры образуется PtO2 и одновременно идет процесс возгонки оксида. При атмосферном давлении кислорода концентрация платины в виде газообразного оксида Pt02 составляет при 1227 оС 3·10-5 г/л.
При нагревании в атмосфере воздуха на окисление и потерю массы металлов платиновой группы оказывают большое влияние и другие газы, адсорбирующиеся на поверхности металла (пары воды, азот, водород, СО).
2. Химические свойства платиновых металлов 2.1 Галогениды платиновых металлов
Галогениды платиновых металлов образуются в процессах галогенирования тонкодисперсных порошков металлов и их солей, а также при прокаливании галогенидов этих металлов в инертной атмосфере или в атмосфере соответствующего галогена. Полученные из водных растворов галогениды содержат воду, при полном удалении которой, как правило, начинается их разрушение.
В кристаллическом состоянии безводные «простые» галогениды – это полимерные цепи, связанные галогеномостиками, образующие часто различные модификации. С фтором характерно образование соединений в высших степенях окисления, напротив, с иодом образуются соединения в низших степенях окисления.
Бинарные фториды обpaзуютcя обычно при непосредственном взаимодействии платиновых металлов с фторирующими агентами. Во фторидах проявляются высшие и необычные степени окисления. OsF7 - единственный из известных гептафторидов металлов платиновой группы. Получают его из элементов при 600 oC и давлении 400 атм. Из дифторидов известен только PdF2, обладающий парамагнетизмом.
Фториды «легких» металлов – рутения, родия, палладия – образуются при фторировании отработавших тепловыделяющих элементов ядерных реакторов. Фториды «тяжелых» платиновых металлов, в частности осмия, использовались в качестве материалов в реакциях синтеза сверхтяжелых элементов, а РtF6 – в качестве мощного фторирующего агента в реакциях с инертными газами.
Все платиновые металлы в мелкораздробленном состоянии при нагревании реагируют с хлором с образованием различных бинарных галогенидов. Наиболее важными из них в практическом отношении являются:
· b-RuCl3 – трихлорид рутения, образуется при взаимодействии порошка рутения со смесью Cl2 и CO (3:1) при 330–340 oC, темно-коричневый порошок, растворимый в органических растворителях;
· «RuOHCl3» – «гидроксотрихлорид» рутения, продажный препарат, образующийся при продолжительном взаимодействии RuO4 с соляной кислотой и последующем выпаривании раствора. Индивидуальным веществом не является. Применяется как исходное в синтезе различных соединений и материалов;
· RhCl3 – трихлорид родия, существует в нерастворимой безводной форме и в форме растворимого гидрата; последний широко применяется для синтеза препаратов, катализаторов и пр.;
· PdCl2 – дихлорид палладия, также существует в нескольких кристаллических модификациях, наиболее важным является дигидрат PdCl2·2H2O; получают самыми разными способами, например, нагреванием палладийхлористоводородной кислоты в атмосфере хлора.
· Бромиды и иодиды платиновых металлов, образующиеся при непосредственном взаимодействии элементов (безводные) либо растворением гидроксидов в соответствующих галогеноводородных кислотах. Они мало изучены.
2.2 Гидроксиды платиновых металловМеталлы платиновой группы образуют аморфные малорастворимые гидроксиды состава MxOy·nH2O. О строении гидроксодов нет единого мнения. Их нередко называют фазами переменного состава. В то же время, независимо от способа синтеза – обычно гидролизом различных соединений при рН ~ 3 ¸ 9, свойства и состав их четко воспроизводятся.
Свежеосажденные гидроксиды – ярко-окрашенные многоводные гели, при высушивании вода удаляется. Температура полного удаления воды может превышать 650 oC, при этом образуются оксиды платиновых металлов.
Гидроксиды платиновых металлов имеют самое разнообразное применение, в том числе в технологии и анализе – в связи с их низкой растворимостью, в катализе, для получения электролитов смешанных и бинарных оксидов, в препаративной практике.
2.3 Взаимодействие платиновых металлов с кислотами и щелочамиПлатиновые металлы, обладающие высоким значением потенциала ионизации, при обычной температуре характеризуются большой устойчивостью по отношению к химическому воздействию кислот и щелочей. Если расположить их в порядке понижения относительной коррозионной стойкости в кислотах, щелочах и окислителях, получим следующий ряд: иридий > рутений > родий > осмий > платина > палладий. В значительной степени реакционная способность платиновых металлов определяется степенью их дисперсности, склонностью к образованию интерметаллических соединений с другими элементами, присутствующими в металле или сплаве, и часто зависит от присутствия посторонних примесей. Наибольшей реакционной способностью при растворении МПГ обладает металлическая чернь, Губка и порошкообразные металлы менее активны, компактные металлы растворяются очень медленно.
Платиновые металлы, обладающие высоким значением потенциала ионизации (табл. 1), при обычной температуре характеризуются большой устойчивостью по отношению к химическому воздействию кислот и щелочей. Если расположить их в порядке понижения относительной коррозионной стойкости в кислотах, щелочах и окислителях, получим следующий ряд: иридий > рутений > родий > осмий > платина > палладий.
Качественная оценка коррозийной устойчивости МПГ по отношению к различным химическим реагентам приведена в табл. 2
Таблица 2. Качественная оценка коррозии МПГУсловные обозначения: А – коррозия отсутствует, Б – слабо подвержен коррозии, В-подвержен коррозии, Г – быстро корродирует
| Коррозийная среда | t t, 0 C | Металлы | |||||
| RRu | RRh | PPd | OOs | IIr | PPt | ||
| H2SO4 конц. | 118 | fA | AA | AA | AA | AA | AA |
| То же | 1100 | БА | БА | ББ | АА | АА | АА |
| То же | 2250 | ББ | ББ | ВВ | ББ | БА | АБ |
| HNO3, 0.1 н | 118 | АА | АА | АА | – | АА | АА |
| HNO3, 1 н | 118 | АА | АА | ББ | – | АА | АА |
| HNO3,2 н | 118 | АА | АА | ВВ | ББ | АА | АА |
| HNO3, 70% | 118 | АА | АА | ГГ | ВВ | АА | АА |
| То же | 1100 | АА | АА | ГГ | ГГ | АА | АА |
| HNO3 дымящаяся | 118 | АА | АА | ГГ | ГГ | АА | АА |
| HCl, 36% | 118 | АА | АА | АА, Б | АА | АА | АА |
| То же | 1100 | АА | АА | ББ | ВВ | АА | ББ |
| «Царская водка» | 118 | АА | АА | ГГ | ГГ | АА | ГГ |
| H3PO4 | 1100 | АА | АА | ББ | ГГ | АА | АА |
| HF 40% | 118 | АА | АА | АА | АА | АА | АА |
| HClO4 | 118–100 | - | - | АА | - | - | АА |
| HBr (d = 1.7) | 118 | АА | ББ | ГГ | АА | АА | ББ |
| То же | 1100 | АА | АА | ГГ | ГГ, В | АА | ГГ |
| HI (d = 1.75) | 118 | АА | АА | ГГ | ББ | АА | АА |
| То же | 1100 | АА | АА | ГГ | ВВ | АА | ГГ |
| Cl2 (сухой) | 118 | АА | АА | ВВ | АА | АА | ББ |
| Cl2 (влажный) | 118 | АА | АА | ГГ | ВВ | АА | ББ |
| Br2(жидкий сухой) | 118 | АА | АА | ГГ | ГГ | АА | ВВ |
| Br2 (жидкий влажный) | 118 | АА | АА | ГГ | ББ | АА | ВВ |
| Раствор NaClO | 118 | ГГ | ББ | ВВ | ГГ | АА | АА |
| S | 1100 | АА | АА | АА | АА | АА | АА |
| NaOH расплав | ВВ | ББ | ББ | ВВ | ББ | ББ | |
| Na2o2 расплав | ВВ | ББ | ГГ | ВВ | ВВ | ГГ | |
| Na2CO3 расплав | ББ | ББ | ББ | ГГ | АА | АА | |
| NaNO3 расплав | АА | АА | ВВ | ВГ | АА | АА | |
Чистый рутениевый порошок или губка лишь незначительно подвержены действию горячих минеральных кислот или их смесей. Однако при нагревании со смесью HCl и HClO3 или с HNO3 в запаянном сосуде рутений количественно растворяется.
Концентрированная дымящая азотная кислота окисляет мел-кораздробленный осмий, однако количественного растворения не наблюдается. Осмий окисляется кипящей серной кислотой с образованием OsO4
Металлический родий в компактном состоянии и в виде порошка не растворяется в «царской водке» и в отдельных минеральных кислотах, за исключением концентрированной серной кислоты. Серная кислота, особенно горячая, растворяет порошкообразный родий, образуя желтый раствор. Считают, что чистый компактный родий обычно не растворяется ни в одной из кислот, хотя известно, что родиевая чернь растворима в «царской водке» и соляной кислоте, насыщенной воздухом. Тем не менее, для количественного растворения металлического родия в любой форме эти реагенты рекомендовать нельзя.
Губчатый иридий очень устойчив к действию минеральных кислот и их смесей как на холоду, так и при нагревании. Как и другие металлы платиновой группы, при повышенном давлении иридий реагирует с соляной кислотой, содержащей воздух; однако для количественного растворения такой метод также непригоден. Сплавы иридия с платиной и палладием растворяются в «царской водке». При содержании в сплаве более 10% иридия растворимость его резко уменьшается.
Металлический палладий растворяется в азотной и серной кислотах и особенно легко в «царской водке». В форме компактного металла палладий даже в жестких условиях не реагирует с соляной кислотой, не содержащей окислителей; свежеосажденный палладий можно количественно растворить в соляной кислоте.
Платина в виде губки легко растворяется в «царской водке», с азотной кислотой в обычных условиях не взаимодействует. Компактная платина в виде проволоки иногда с трудом растворяется в «царской водке», поэтому для количественного растворения больших количеств такой платины простой обработки кислотами недостаточно. Порошкообразная платина реагирует с соляной кислотой, содержащей кислород.
Металлический рутений легко сплавляется с окислительными смесями, состоящими из щелочи и нитрата калия, при сплавлении образуются рутенаты. Полученный сплав легко растворяется в водных растворах минерапьных кислот.
Металлический палладий легко сплавляется с NaOH или КОН, в обоих случаях образуются черные пористые осадки.
При сплавлении с щелочью осмий превращается в оксид осмия(VIII), который, растворяясь в сплаве, дает [OsO4(OH)2]2- Сплавление металлического родия с NaOH приводит к образованию коричневой оксидной пленки и незначительному растворению металла в щелочном расплаве. С КОН он сплавляется легче, чем с NаОН. Его можнo сплавить со смесью щелочи и КNО3; сплав состоит из нерастворимых в воде оксидов, которые легко растворяются в кислотах.
Губчатый иридий легко переходит в раствор при щелочно-окислительной плавке со смесью щелочи и KNO3. Металлический иридий легче, чем родий, сплавляется с NaOH при 410 0С, с КОН сплавление происходит сравнительно быстро. Образующиеся при сплавлении с щелочами оксиды легко растворимы в «царской водке».
2.4 Способы вскрытия платиновых металлов
Наиболее распространенными способами переведения в раствор отдельных платиновых металлов, их сплавов, а также материалов, содержащих одновременно несколько металлов платиновой группы, являются следующие:
1. растворение в кислотах или в смесях кислот (главным образом платины, палладия и их сплавов с металлами).
2. электролитическое растворение в кислотах при помощи переменного тока.
3. хлорирование.
4. сплавление или спекание с щелочами или пероксидами щелочных (щелочноземельных) металлов (табл. 3).
Таблица 3. Способы переведения в раствор аффинированных порошков платиновых металлов| Металл | Способ переведения в раствор |
| Pd | Обработка HNO3 |
| Pd, Pt | Обработка «царской водкой» |
| Pt, Pd, Rh*, Os*, Ir*, Ru* | Обработка конц. HCl+Cl2 |
| Pt, Pd, Ru, Ir, Os | Хлорирование (фторирование) в присутствии твердых галогенидов щелочных металлов при 400–600 0С с последующим растворением в кислотах |
| Pt, Pd, Ru, Rh, Ir, Os | Хлорирование (фторирование) в присутствии твердых галогенидов щелочных металлов с последующим растворением в кислотах |
| Pt, Pd, Ru, Rh, Ir, Os | Сплавление с пероксидами или гидроксидами щелочных металлов в присутствии нитратов при 500–9000С с последующим растворением в кислотах |
| Pd, Ru, Rh, Ir, Os | Электрохимическое анодное растворение |
*Частично растворяется
Для растворения платиновых металлов пригодны: «царская водка» для платины; «царская водка» или горячие минеральные кислоты для палладия; горячая концентрированная и серная кислоты для родия. Иридий, рутений и осмий не растворяются в кислотах.
Электролитическое растворение металлов платиновой группы при помощи переменного или постоянного токов чаще всего используют для растворения родия, иридия и рутения – металлов, нерастворимых в кислотах. В качестве электролитов используют HCl, HNO3, H2SO4, HBr и раствор щелочи. Значения стандартных окислительно-восстановительных потенциалов, а также диаграммы Пурбэ, учитывающие влияние рН комплексообразования на величину Ео некоторых металлов даны в Приложениях.
Хлорирование платиновых металлов, особенно в присутствии галогенидов щелочных металлов, – распостраненный способ переведения этих элементов в растворимые в воде и кислоте соединения. Если при взаимодействии с хлором при высоких температурах образуются бинарные хлориды, то при хлорировании газообразным хлором в присутствии NaCl образуются растворимые в воде и соляной кислоте комплексные хлориды платиновых металлов.
Некоторыми преимуществами по сравнению с методом сухого хлорирования обладает способ растворения в соляной кислоте в присутствии окислителя (HNO3, Cl2, HClO4, NaClO3) под давлением в запаянной ампуле. Хлорирование таким методом позволяет избежать потери осмия из-за летучести его хлоридов и образования нерастворимых солей в соляной кислоте бинарных хлоридов рутения и платины, а также не требует введения в полученный раствор солей натрия и других реагентов. Однако по сравнению с хлорированием сухим хлором метод требует более сложного аппаратурного оформления.
Успешно идет растворение платиновых металлов методом окислительного сплавления (спекания) со щелочами и пероксидами. Платиновые металлы при сплавлении со щелочами в присутствии окислителей образуют соединения, растворимые в воде, HCl, HBr и «царской водке». Для сплавления применяют следующие смеси: NaOH (KOH) и NaNO3 или KClO3, K2CO3 и NaNO3 (KNO3), BaO2 и Ba(NO3)2, Na2O2. Обычно сплавление с щелочами в присутствии нитратов, сплавление с Na2O2 или спекание с BaO2 считают удобным способом переведения в растворимые соединения таких металлов, как рутений, осмий, родий, иридий. К недостаткам метода относится наличие загрязнений, вносимых из тиглей, и большого количества солей в плаве. Сплавление или спекание с щелочами обычно осуществляется в никелевых, серебряных или корундовых тиглях.
Перспективными для практического использования могут рассматриваться фторокомпексы платиновых металлов, образующиеся при фторировании платиновых металлов и платиносодержащего сырья в присутствии фторидов щелочных металлов. Фторирующим агентом служит газообразный фтор F2, либо трифторид брома BrF3 – крайне реакционноспособный апротонный растворитель. Фторирование применяется:
Похожие работы
... . При уменьшении концентрации соляной кислоты величина десорбции падает. Выводы 1. Волокна ЦМ-А2, Мтилон-Т и ВАГ можно использовать для сорбции палладия из хлоридных растворов. 2. По изотермам сорбции палладия волокнами ЦМ-А2, Мтилон-Т и ВАГ установлено, что на волокне Мтилон-Т сорбционная емкость больше, чем на волокне ЦМ-А2 и ВАГ и составляет 2,92 ± 0,1 мг-экв/г, 2,13 ± 0,1 мг-экв/г и ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
... СССР, носящий ныне имя академика Н.С. Курнакова. В этом институте под руководством выдающихся ученых – Л.А. Чугаева, Н.С. Курнакова, И.И. Черняева – были выполнены многочисленные исследования по химии и технологии платины и других благородных металлов. Результаты этих исследований стали научной основой нынешней платиновой промышленности Советского Союза. Получение платины Казалось бы, раз ...
... ] — кристаллическое вещество оранжевого цвета, устойчиво при 20° С, в вакууме возгоняется без разложения. Синтез Xe[PtF6] ярился началом широких исследований, приведших к получению соединений благородных газов. Заключение Химия платины очень объемна, сложна и интересна. Пожалуй, наиболее общим свойством ее соединений является узкий температурный интервал их стабильности, связанный с высоким ...







0 комментариев