Навигация
К кусочку мела или мрамора прилить несколько капель соляной кислоты. Объяснить наблюдаемые явления и написать уравнения реакций
3. К кусочку мела или мрамора прилить несколько капель соляной кислоты. Объяснить наблюдаемые явления и написать уравнения реакций.
Утилизация. Содержимое пробирки с соединениями бария перенести в нейтрализатор. К содержимому пробирки с соединениями серебра поднести универсальную индикаторную бумагу. Если среда сильнокислая, то раствор можно использовать повторно для обнаружения хлорид–ионов. Если среда слабокислая - использовать повторно в этом же опыте.
Опыт № 6. Ознакомление со свойствами карбонатов и гидрокарбонатов
Оборудование и реактивы: Штатив с лапкой, резиновые прокладки, спиртовка, спички, пробирки, пробка со вставленной в нее газоотводной трубкой, гидрокарбонат натрия (порошок), известковая вода, шпатель.
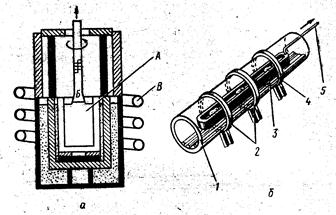
Ход работы: Собрать прибор согласно рис. 26. Насыпать в пробирку (1/3 ее объема) гидрокарбоната натрия и закрыть пробкой с газоотводной трубкой. Закрепить пробирку в лапке штатива так, чтобы дно было выше отверстия. Опустить газоотводную трубку в пробирку с известковой водой заполненной на ¼ ее объема. Нагреть всю пробирку, а затем то место, где находится порошок гидрокарбоната натрия. После помутнения известковой воды продолжайте пропускать углекислый газ до растворения осадка. Пробирку с прозрачным раствором прокипятите. Выразите процессы уравнениями реакций.
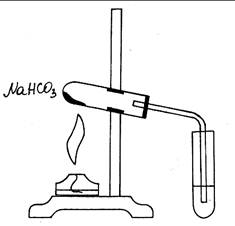
Рис.26. Разложение гидрокарбоната натрия.
Техника безопасности: 1. Пробирку с гидрокарбонатом натрия закрепить так, чтобы дно было выше отверстия, т. к. в ходе реакции образуется вода. Это предотвратит ее стекание в раскаленную реакционную смесь и растрескивание пробирки. 2. Заканчивать опыт необходимо в следующем порядке:
а) удалить газоотводную трубку из пробирки с известковой водой;
б) прекратить нагревание.
Утилизация. Все растворы и остатки разложения гидрокарбоната натрия поместить в емкость-нейтрализатор.
Опыт № 7. Испытания растворов карбонатов и силикатов индикаторами
Оборудование и реактивы: Пробирки, стеклянные палочки, красный лакмус, разбавленные растворы углекислого натрия и силиката натрия.
Ход работы: В одну пробирку налить раствор углекислого натрия, в другую раствор силиката натрия объемом 1 мл. Промыть стеклянную палочку дистиллированной водой и с ее помощью перенести одну – две капли каждого раствора на красную лакмусовую бумагу. В какой цвет окрашивается лакмус? Сделайте вывод о степени гидролиза углекислого натрия и силиката натрия. Написать уравнения гидролиза указанных солей в сокращенной ионной, полной ионной и молекулярной форме.
Утилизация. Растворы солей поместить в нейтрализатор.
Опыт № 8. Получение кремневой кислоты
Оборудование и реактивы: Пробирка, стеклянная палочка, химический стакан, раствор силиката натрия, раствор соляной кислоты.
Ход работы: В пробирку к 1 мл раствора силиката натрия (разбавляют конторский клей в соотношении 1:1) приливают 0,5 мл раствора соляной кислоты (1:1). Содержимое пробирки перемешивают стеклянной палочкой. Получают гель кремневой кислоты. Надо избегать избытка соляной кислоты. При иных соотношениях растворов кислоты и соли получается золь кремневой кислоты.
Техника безопасности: Быстро вымыть пробирку с гелем кремневой кислоты, чем предотвратим ее затвердевание.
Опыт № 9. Выделение кремневой кислоты из силикатов угольной кислотой
Оборудование и реактивы: Аппарат Киппа, пробирка, химический стакан, мрамор, соляная кислота (1:2), 10 % раствор силиката натрия, шпатель.
Ход работы: Зарядить аппарат Киппа на получение углекислого газа (рис. 27). В пробирку налить раствор силиката натрия и пропустить ток углекислого газа из аппарата Киппа. Через 3-5 мин. в пробирке выпадает гель кремневой кислоты. Кремневая кислота вытесняется из раствора ее соли слабой угольной кислотой. Объясните явления и запишите уравнения реакций.
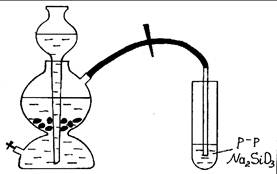
Рис. 27. Получение кремневой кислоты.
Техника безопасности: Быстро вымыть пробирку с гелем кремневой кислоты во избежание его затвердевания.
Утилизация. Содержимое пробирок в опыте № 8 и 9 сливают в раковину, в них отсутствуют токсичные вещества. Отработанную соляную кислоту в аппарате Киппа утилизируют по схеме в теме: “ Вода. Растворы. Основания.”, VIII класс, опыт № 8.
ЛАБОРАТОРНАЯ РАБОТА № 2
ТЕМА: ”МЕТАЛЛЫ”
Опыт № 1. Электролиз раствора хлорида меди CuCI2
Оборудование и реактивы: Штатив с лапкой, резиновые прокладки, U-образная трубка, выпрямитель, угольные электроды, 5 % раствор хлорида меди, раствор крахмального клейстера, 5% раствор KI.
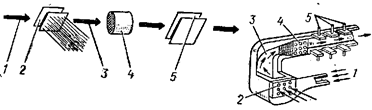
Ход работы: Опыт проводят в U-образной трубке с угольными электродами (рис. 28). В U-образную трубку наливают раствор хлорида меди, в каждое колено трубки помещают угольный электрод и герметично закрывают. Включают ток от аккумулятора или от сети через выпрямитель (U=10В). Через 2-3 мин. на катоде появляется налет меди. Пипеткой взять жидкость из анодной части U-образной трубки и добавить к ней несколько капель раствора KI и крахмала (предварительно отключить прибор от электропитания).
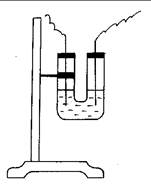
Рис. 28. Электролиз раствора хлорида меди.
Наблюдается изменение окраски на синий цвет. Написать уравнения процессов, объяснить наблюдаемые явления.
Техника безопасности: 1. Не допускать попадания хлора в атмосферу класса.
Похожие работы
... инертны и практически не взаимодействуют ни с какими простыми и сложными веществами. Исключение составляет аморфный кремний, реагирующий с фтором. При нагревании углерод и кремний взаимодействуют с галогенами, с элементами подгруппы серы, азотом, водородом и многими металлами. В последнем случае образуются соединения, называемые карбидами и силицидами. С углеродом и кремнием взаимодействуют ...
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...
... (вода, спирты, аммиак) за счет притяжения разноименных зарядов. Прочность водородной связи существенно (~20 раз) меньше, чем ионной или ковалентной связи. Билет №4. Классификация химических реакций в неорганической химии. Классификация по составу исходных веществ и продуктов реакции. Реакции соединения — из нескольких веществ (простых или сложных) образуется сложное вещество: Реакции ...
... подгрупп одной группы — химические антиподы: для одних должны быть более характерны свойства металлов, а для других — неметаллов. Но при сравнении членов обеих подгрупп можно заметить, что «противоположности» сближаются. У элементов побочной подгруппы все более усиливаются свойства неметаллов, характерные для главной подгруппы, и наоборот. Ванадий в этом отношении служит примером. В высшей ...







0 комментариев