Навигация
Разбирать прибор под тягой при получении больших количеств хлора
2. Разбирать прибор под тягой при получении больших количеств хлора.
3. С электроприбором работать, не касаясь оголенных проводов.
Утилизация. При описанной методике выполнения опыта раствор хлорида меди можно использовать многократно.
Опыт № 2. Электролиз раствора йодида калия
Оборудование и реактивы: Штатив с лапкой, резиновые прокладки, U-образная трубка, выпрямитель, угольные электроды, 5 % раствор йодида калия, крахмал, фенолфталеин.
Ход работы: Прибор такой же, как в опыте №1. В U-образную трубку наливают раствор йодистого калия и опускают угольные электроды. Включают ток от сети через выпрямитель. По окончании электролиза из трубки, где находится катод, взять пипеткой пробу на щелочь с фенолфталеином. Появляется малиновая окраска. Из трубки, где находится анод, отбираем пипеткой пробу раствора на обнаружение иода с крахмалом. В присутствии йода крахмал синеет. Объяснить наблюдаемые явления, написать уравнения реакций.
Утилизация. Раствор иодида калия приобретает коричневую окраску от растворенного в нем йода. Использовать его повторно не представляется возможным. Полученную смесь нейтрализуют несколькими каплями раствора соляной кислоты (контроль по лакмусовой бумаге). Используют раствор для обнаружения непредельных углеводородов, а также для получения йода: 2KI + Cl2 ® 2KCl + I2¯. Для получения прозрачного раствора иодида калия к смеси из U-образной трубки добавляют порошок цинка и сильно встряхивают: Zn + I2 ® ZnI2. Избыточной порошок цинка отфильтровывают. Полученный раствор смеси иодида калия и иодида цинка можно использовать для демонстрации процесса электролиза.
Опыт № 3. Электрохимический ряд напряжений металлов
а) Вытеснение водорода металлами из кислот
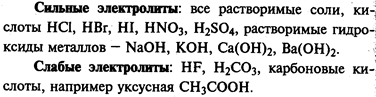
Оборудование и реактивы: 5 пробирок, штатив для пробирок, шпатель, раствор соляной кислоты (1:3); металлы: магний, алюминий, железо, медь, цинк. Все металлы в виде порошка.
Ход работы: Берут пять пробирок с раствором соляной кислоты и в каждую из них помещают порошки цинка, магния, алюминия, железа и меди в равных порциях. В первых четырех пробирках идет интенсивное выделение водорода (интенсивность выделения уменьшается от магния к железу). В пробирке с медью выделение водорода не происходит. Написать соответствующие уравнения реакций. Объяснить, почему реакция с алюминием идет вначале очень медленно.
Утилизация. Во все пробирки добавить при полном растворении в них указанных металлов соответствующие оксиды или гидроксиды в небольшом избытке. Затем растворы фильтруют, остатки добавленных оксидов и гидроксидов промывают, сушат и используют вновь. Полученные растворы MgCl2, AlCl3, ZnCl2 используют в лаборатории. Раствор FeCl2 и FeCl3 в пробирке с железом помещают в нейтрализатор. Медь из раствора соляной кислоты фильтрованием отделяют от кислоты. Медь и кислоту используют вновь.
б) Вытеснение металла из раствора соли другим металлом
Оборудование: Три пробирки, штатив для пробирок, шпатель, разбавленные растворы: нитрата свинца (II), сульфата меди, нитрата серебра; металлы: цинк, железо, медь (в виде предметов).
Ход работы: В одну пробирку наливают раствор нитрата свинца, во вторую – сульфата меди, в третью – нитрата серебра. В первую пробирку опускают кусочек цинка, во вторую железный гвоздь и в третью – медную проволоку. Через некоторое время в первой пробирке обнаруживаются блестящие, рыхлые кристаллы свинца; во второй пробирке – хлопья меди и в третьей – блестящее, серебряное покрытие. Написать соответствующие уравнения реакций, сделать выводы.
Техника безопасности: Вымыть тщательно руки при попадании растворов солей свинца, меди, серебра.
Утилизация. Отделить кусочки металлов от растворов солей, очистить от осажденных на них свинца, меди и серебра механически, металлы использовать вновь. Растворы солей использовать многократно, поместив их в соответствующие склянки с этикеткой: PbNO3 + ZnNO3; CuSO4 + FeSO4; AgNO3 + Cu (NO3)2.
Опыт № 4. Химическая коррозия
Вариант (а): Оборудование: Тигельные щипцы, спиртовка, спички, медная и железная пластинки, наждачная бумага.
Ход работы: С помощью наждачной бумаги хорошо очищают медную и железную пластинки. Каждую из них берут тигельными щипцами и нагревают в течение 2-3 мин. в пламени спиртовки. Медная пластинка покрывается темным налетом (CuO), а железная – окалиной (Fe 3O4). При повышенной температуре происходит взаимодействие металлов с кислородом воздуха – процесс химической коррозии.
Вариант (б): Оборудование: Тигельные щипцы, спиртовка, спички, медная пластинка, молоток.
Ход работы: Складывают вдвое тонкую медную пластину и сплющивают ее молотком (особенно тщательно по краям). Пластинку берут тигельными щипцами и нагревают в пламени спиртовки до образования темного налета оксида меди. Когда пластинка остынет, ее разворачивают и рассматривают. Внутри пластинки черного оксида меди нет, т.к. эта часть пластинки не соприкасалась с кислородом воздуха.
Опыт № 5. Электрохимическая коррозия
Похожие работы
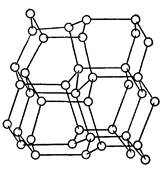
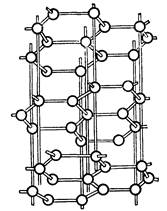
... инертны и практически не взаимодействуют ни с какими простыми и сложными веществами. Исключение составляет аморфный кремний, реагирующий с фтором. При нагревании углерод и кремний взаимодействуют с галогенами, с элементами подгруппы серы, азотом, водородом и многими металлами. В последнем случае образуются соединения, называемые карбидами и силицидами. С углеродом и кремнием взаимодействуют ...
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...
... (вода, спирты, аммиак) за счет притяжения разноименных зарядов. Прочность водородной связи существенно (~20 раз) меньше, чем ионной или ковалентной связи. Билет №4. Классификация химических реакций в неорганической химии. Классификация по составу исходных веществ и продуктов реакции. Реакции соединения — из нескольких веществ (простых или сложных) образуется сложное вещество: Реакции ...
... подгрупп одной группы — химические антиподы: для одних должны быть более характерны свойства металлов, а для других — неметаллов. Но при сравнении членов обеих подгрупп можно заметить, что «противоположности» сближаются. У элементов побочной подгруппы все более усиливаются свойства неметаллов, характерные для главной подгруппы, и наоборот. Ванадий в этом отношении служит примером. В высшей ...







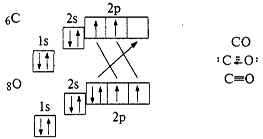
0 комментариев