Навигация
2.5.1 С водородом
Молибден не реагирует с водородом с получением химических соединений. Имеет место только физическое растворение водорода в молибдене с образованием нестойких связей. Растворимость водорода в молибдене растет с повышением температуры до 0,5 см3 в 100 граммах металла [20].
2.5.2 С галогенами
С молибденом фтор образует летучие фториды. Хлор и бром ре6агируют с ним при температуре красного каления. Йод реагирует с молибденом очень медленно. В присутствии влаги реакция с галогенами ускоряется и она становится возможной даже на холоду.
Молибден образует гексафторид MoF6, пентафторид MoF5, тетрафторид MOF4 и трифторид MоF3; гексахлорид МоС16, пентахлорид МоС15, тетрахлорид МоС13, трихлорид МоС13 и комплексный псевдодихлорид [Мо6(С1)8]С14; тетрабромид МоВг4, трибромид МоВг3 и комплексный псевдодибромид [Мо6Вг8]Вг4 [20, 23]. С иодом достоверно известно лишь два соединения – дииодид МоІ2 и трииодид МоІ3. Помимо этих соединений, известен ряд оксигалогенидов и несколько менее достоверных соединений.
Гексафторид молибдена получается действием сухого фтора в смеси с азотом на металл (в платиновой трубке), трифторида брома на металл при 250°, безводного HF на MoCl5:
2МоС15 + 12HF = 2MoF6 + 10НС1 + Н2
![]()
Гексафторид конденсируется при -70°С в виде белых кристаллов и отгоняется под вакуумом при 40°. Плавится при 17,5°С и кипит при 35°С. Молекула имеет октаэдрическую структуру с атомом металла в центре октаэдра и атомами фтора в вершинах его. Устойчив в сухом воздухе, хлоре, двуокиси серы. Гидролизуется:
MoF6 + 4Н2О = Н2МоО4 + 6HF
Образует с фторидами щелочных металлов комплексные соли типа Me2(MоF8).
Трифторид молибдена получается нагреванием МоВг3 в токе безводного HF. При нормальных условиях твердый. При нагревании во влажном воздухе диссоциирует:
4MoF3 + 6Н2О + 3O2 = 4МоО3 + 12HF
В сухом воздухе устойчив до 800°. При действии водорода восстанавливается до металла. Водой на холоду медленно разлагается.
У молибдена (VI) выделены два оксифторида - MoOF4и MоO2F2. Это твердые, белые, тяжелые кристаллические вещества, получающиеся фторированием молибдена в присутствии кислорода или обменными реакциями МоО3 с фторидами.
![]()
MoCl6 термически очень неустойчив и чувствителен к малейшим следам влаги. Получен недавно длительным кипячением тионилхлорида с МоО3. МоС15 получается хлорированием молибдена в отсутствие воды и воздуха при 600 – 750°С. Кристаллизуется в виде темно-зеленых тригональных бипирамид. Температура плавления 194°С, температура кипения 238°С. Плотность МоС15 2,9275. Он растворяется в безводном эфире,спиртах, углеводородах, кетонах, альдегидах, сероуглероде, аминах с образованием комплексов. При нагревании в отсутствии кислорода разлагается:
МоС15 = МоС13 + С12
Водород при 900°С восстанавливает его до металла:
2МоС15 + 5Н2 → 10НС1 + 2Мо
Восстанавливать можно над накаленной металлической нитью в токе его пара в смеси с водородом. В этом случае на нити осаждается плотный слой молибдена, но при 250° образуется трихлорид:
МоС15 + Н2 → МоСІ3 + 2НС1
При нагревании МоС15 в сухом воздухе образуется оксихлорид МоО2С12. При нагревании во влажном воздухе МоС15 полностью разлагается, образуя окси - и гидроксихлориды. В воде полностью гидролизируется с большим выделением тепла.
Тетрахлорид молибдена получается хлорированием МоО3 смесью СІ2 и ССІ4. При нагревании без доступа влаги и кислорода МоСІ4 диспропорционирует на MoCl 5 и MoCl3. При нагревании в присутствии влаги и кислорода образуются оксихлориды и гидроксихлориды. С рядом веществ, в том числе органических, тетрахлорид образует продукты присоединения.
Трихлорид МоС13 получается в виде твердого красного вещества частичным восстановлением MoCl5 водородом при 250°, а также пропусканием смеси паров МоС15 с инертным газом над молибденом.
![]()
Трихлорид разлагается, не плавясь. Сублимирует в токе инертного газа. Устойчив в сухом воздухе при нормальной температуре, а при нагревании переходит в оксихлориды. При нагревании в инертном газе разлагается на МоСІ4 и комплексные нелетучие хлориды. Водой и водными растворами щелочей разлагается соответственно при нагревании и на холоду. С аммиаком образует комплексы. Окислителями окисляется до Н2МоО4. В соляной кислоте не растворяется. Растворяется в солянокислых растворах МоО3, образуя комплексы.
Все бромиды получаются действием Вг2 на Мо в среде СО. Так, черно-зеленые иглы тетрабромида получаются около 600°С при атмосферном давлении, тетрабромид – преимущественно при 350 – 500°С. При более низком давлении или несколько более высокой температуре получается смесь бромидов, в том числе комплексных. Известны также красно-оранжевые кристаллы диоксибромида МоО2Вг2 и желтые игольчатые кристаллы бромомолибденовой кислоты H3(MoO3Br3).
![]()
Достоверно известен лишь диодид молибдена Mol2 [23]. Получается он взаимодействием паров йода с металлом выше 1000°С:
![]()
Другие йодиды молибдена неизвестны.
Похожие работы
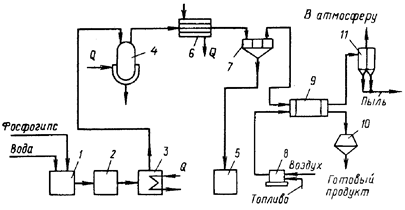
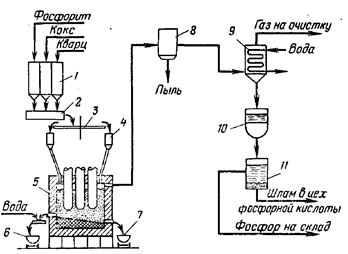
... из отработанных катализаторов и химических остатков [16]. 3.3 Молибден из колошниковой пыли плавильных печей Этот процесс, разработанный X. Кастанья, предназначен для выделения молибдена в виде молибденовой кислоты из отходов, в частности, из отработанных катализаторов, содержащих носитель - у-оксид алюминия и молибден в виде оксида или сульфида. Процесс включает обработку отходов ...
... молибдена и др. Эти материалы могут быть использованы в качестве легирующие компоненты для выплавки легированных чугуну и стали. Результаты исследований [11] показали, что использование отработанных никелевых катализаторов позволяет получать заготовку шихты с содержанием никеля 11 % и ванадию 3 % при одношлаковом режиме плавки. 1.2 Особенности редкофазной обновительной плавки. Выполненный ...
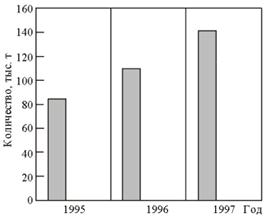
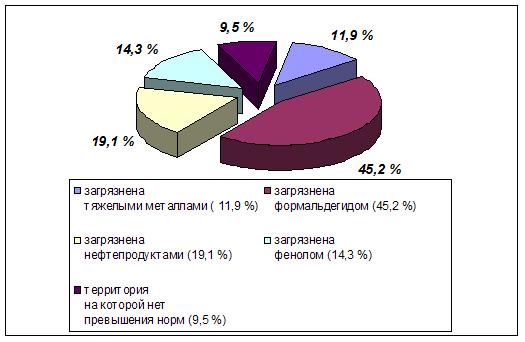
... отходам производства. В докладе «О состоянии окружающей природной среды Российской Федерации в 1997 году» Государственного комитета Российской Федерации по охране окружающей среды отмечается, что на начало 1997 г. на предприятиях различных отраслей промышленности накоплено 1431,7 млн. т токсичных отходов. За 1997 г. на промышленных предприятиях РФ образовалось 89,4 млн т токсичных отходов, из ...
... . Заражение радиоактивными веществами и происходило ранее при воздушных и подводных испытаниях атомных бомб, а сейчас может произойти — при авариях атомных подводных лодок. Усиливается загрязнение природной среды твердыми промышленно-бытовыми отходами. Это вышедшие из употребления упаковочные материалы, бытовые и промышленные приборы, машины, бумага, консервные банки и, бутылки, остатки пищи, ...
0 комментариев