Навигация
Получение гетерополикислот
3.5 Получение гетерополикислот
Тетрамолибдат аммония, или, точнее, полимолибдат, так как состав осадка может отклоняться от формулы (NН4)2О∙4МоО3∙2Н2О, осаждают, нейтрализуя аммиачный раствор кислотой, непрерывно перемешивая, до рН 2,5 – 3,5; температуру поддерживают около 55°С [23]. При начальной концентрации раствора 280 – 300 г МоО3 на 1 л в осадок в составе полимолибдата выделяется 96 – 97% Мо, находившегося в растворе до нейтрализации. Необходимо быстро отделять осадок полимолибдата от маточного раствора, иначе может образовываться мелкокристаллическая труднофильтрующаяся безводная соль. Осадки достаточно чисты, так как примеси металлов, мышьяка, фосфора, серы остаются в основном в растворе.
В осадок полимолибдат увлекает большое количество ионов хлора и вольфрам. Перекристаллизацией полимолибдата в парасоль 3(NH4)2О ∙ 7МоО3 ∙ 4Н2О эти примеси удаляют. Для этого полисоль растворяют в 3 – 5 % -ном растворе аммиака при 70 – 80°С столько, чтобы плотность стала 1,41 – 1,42. Затем, охлаждая раствор до 15 – 20°С, кристаллизуют парамолибдат аммония:
7 [(NH4)2О ∙ 4МоО3] + 10NH4OH → 4 [3 (NH4)2О ∙ 7МоО3] + 5Н2О
В кристаллы выделяется до 60% всего молибдена, бывшего в растворе. Оставшийся маточный раствор без очистки используют для перекристаллизации ряда порций осадков полимолибдата.
Описанный метод переработки дает конечный продукт более высокой чистоты, чем просто парамолибдатный. Содержание примесей в конечном продукте (%): Fe<0,005; S<0,003; Al<0,003; Zn, Ni, Са, Mg, As, P и других элементов <0,001 каждого. Примесь вольфрама осаждается вместе с молибденом. Для процесса применяются эмалированные чугунные выпарные аппараты и кристаллизаторы. Возможно применение и других аппаратов. В маточных растворах, подлежащих очистке, содержится до 10 г/л Мо. Подкислением до рН 3 – 2 из них можно выделить осадки полимолибдатов, которые направляют на очистку. Из маточных растворов, содержащих < 1г/л Мо, последний выделяют ионообменом.
3.6 Другие методы получения соединений молибдена
По одному из вариантов кислотной обработки отвалы, содержащие помимо соединений молибдена до 5% W, обрабатывают 20 – 30%-ной соляной кислотой при нагревании [8, 20]. Молибден в основном переходит в раствор. Кислотой не разлагаются МоО2, MoS2 минералы вольфрама. Кислую пульпу нейтрализуют раствором аммиака до рН 2,5 – 3. Молибден осаждают в составе молибдата железа или полимолибдатов. Осадок отфильтровывают. С раствором отделяются Са, Си, часть Fe. Осадок обжигают, чтобы окислить Мо и МоO2. После обжига его выщелачивают аммиачным раствором. В полученный раствор извлекается до 85% Мо. Соединения вольфрама остаются в остатке от выщелачивания. Аммиачный раствор молибденовых соединений присоединяют к основному раствору от выщелачивания огарков. Общее извлечение молибдена из концентрата достигает 93 – 95%. Потери при обжиге ~ 1,5 %, при выщелачивании (с использованием хвостов) ~2,5%, на прочих операциях до 3%. Переработка отвалов повышает общее извлечение молибдена из концентратов в готовую продукцию.
Из анализа себестоимости парамолибдата с учетом использования хвостов первичного выщелачивания следует, что более 90% себестоимости составляет стоимость сырья.
Для получения молибдена можно использовать также и растворение в азотной кислоте, но этот процесс имеет несколько отличительных черт. Для рентабельности азотнокислотного вскрытия необходимо, чтобы избыток азотной кислоты и продукты ее разложения могли быть регенерированы и эффективно использованы. В противном случае метод нерентабелен, так как вместо прямого использования кислорода воздуха, как это происходит при окислительном обжиге в печах, окисление производится дорогой азотной кислотой, предварительно полученной тоже из азота и кислорода воздуха. Нельзя допускать и выброса в атмосферу окислов азота, получающихся при разложении кислоты в ходе реакции. Схема азотнокислотного метода показана на рис. 4. Основная реакция взаимодействия M0S2 с HNO3:
MoS2 + 6HNO3 = Н2МоО4 + 2H2SO4 + 6N0
Реальный расход кислоты на окисление чистого MoS2 близок к теоретическому по этой реакции. Но при разложении концентрата кислота расходуется еще и на разложение примесных минералов, испарение, термическое разложение. Поэтому общий расход кислоты значительно выше расчетного (расчетный расход 3,16 т, в пересчете на 60%-ную кислоту, на окисление молибденита в 1 т концентрата, содержащего 48 – 50% Мо).
Некоторые возможные реакции взаимодействия примесных минералов с азотной кислотой:.............................................................................................................
CaCO3 + 2HNO3 = Ca(NO3)2 + H2O + CO2
Са3 (РО4)2 + 6HNO3 = 3Са (NO3)2 + 2Н3РО4
As2S3 + 12HNO3 = 2H3AsO4 + 3H2SO4 + 8NO + 4NO.
Молибденовая кислота первоначально оказывается полностью в растворе, а затем в значительной степени выпадает в осадок. В растворе молибден находится в основном в составе комплексных анионов [MoO(MoO4) (SO4)2]2-. В газовой фазе, помимо NО, находятся другие окислы азота и пары кислот. К концу разложения молибденита азотной кислотой в растворе содержится 15—25 г/л Мо. Растворимость Н2МоО4 в воде ~2 г/л при 20°.
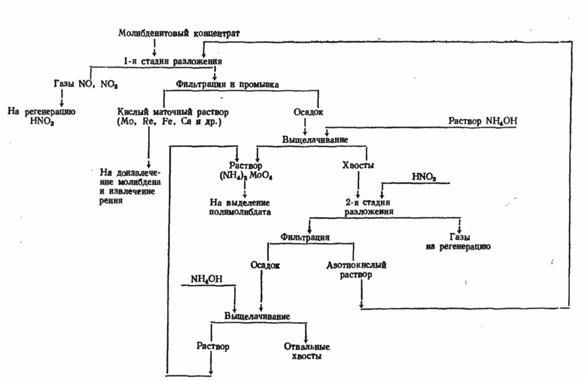
Рис. 4. Получение молибдена с использованием азотной кислоты
Из азотнокислых растворов молибден можно выделить в зависимости от избытка кислоты, содержания молибдена и примесей экстракцией или осаждением ферромолибдата.
Окисление MoS2 гипохлоритом в растворах. Молибденит окисляется гипохлоритом кальция по реакции.
MoS2 + 9СlО- + 6ОН- = МоО![]() + 2SO
+ 2SO![]() + 3Н2О + 9Сl-
+ 3Н2О + 9Сl-
Реакция протекает со значительным выделением свободной энергии: ΔZ298= - 343, 6 ккал. Преимущества процесса гипохлоритного окисления – это избирательность окисления молибдена и полнота извлечения его в раствор при низкой температуре. Практический расход в 1,5 – 2 раза выше теоретического. В заводской практике способ не применяется.
Oкисление молибденита кислородом в автоклавах [20]. Окисление может производиться в растворах КОН, NH4ОН, NaOH, Na2CO3. Принципиальная реакция окисления кислородом проходит по уравнению
2MoS2 + 9O2 +2OH- = 2МоО![]() + 4SO
+ 4SO![]() + 6Н2О
+ 6Н2О
Окисление проходит через промежуточную стадию образования тиосульфата и гидроксокатиона молибдена (VI) [МоО2Н ]+. На степень перехода молибдена в раствор влияют давление, температура, концентрация щелочи. Скорость реакции зависит от концентрации ионов ОН-, поэтому она возрастает в ряду растворов аммиака→соды→щелочи. Ионы меди действуют на окисление каталитически: при концентрации меди 100 мг/л скорость его в два раза выше, чем в отсутствие меди. Добавка меди позволяет снизить давление, температуру и время обработки.
При автоклавном окислении молибдено – медных промпродуктов (5,8 – 6,3% Мо и 6 – 9% Сu) рекомендуется проводить процесс в растворе соды или аммиака при 200°С, а в растворе едкого натра при 130 – 140°С и давлении кислорода соответственно 9 – 10 и 1 – 2 атмосфер. Работая с едким натром, кислород можно заменить сжатым воздухом. В растворах аммиака вместе с молибденом растворяется много меди, что нежелательно. При работе с содой образуется гидрокарбонат:
Na2CO3 + СО2 + Н2О → 2NaHCO3
Избыток соды поэтому должен быть выше, чем щелочи. В качестве аппаратуры можно использовать автоклавы с механическим перемешиванием из нержавеющей стали специальных сортов . Автоклавное выщелачивание связано с трудностями подбора аппаратуры из-за образования больших количеств CaSO4 и в отношении техники безопасности.
Хлорирование молибденовых огарков, окисленных промежуточных продуктов и чистых соединений молибдена. Хлорирование – перспективный метод переработки низкосортных огарков, окисленных концентратов и промежуточных продуктов обогащения, окисленных руд, содержащих молибден. Хлорирование может также применяться для получения чистых хлоридов с целью выработки из них металлического молибдена методами диссоциации или металлотермии. Хлорировать можно хлором, летучими хлоридами (например, S2Cl2, ССl4), твердыми хлоридами. Хлорирование низкосортных концентратов, содержащих сульфиды, целесообразно применять к обожженным «огаркам» таких концентратов. Ректификацией продуктов хлорирования могут быть получены соединения высокой чистоты.
Ионный обмен в технологии молибдена может применяться для:
а) селективного извлечения Мо из основных растворов как относительно богатых им, так и бедных;
б) извлечения очень малых количеств Мо из сбросных растворов и промывных вод;
в) извлечения Мо из рудничных молибденсодержащих вод,
г) разделения Мо и Re в кислых растворах;
д) очистки молибденовых растворов от примесей тяжелых, щелочноземельных и щелочных металлов.
До настоящего времени наиболее широко распространено ионообменное извлечение молибдена из бедных маточных и сбросных растворов и промывных вод [20,11]. Остальные возможности применения ионитов в технологии молибдена весьма перспективны. Ионообменное извлечение из растворов после кислотной обработки бедных окисленных руд и концентратов – актуальная задача, так как эти руды и методы обработки приобретают большое промышленное значение.
Молибден сорбируется и катионитами, и анионитами. Большое практическое значение имеет сорбция молибдена на анионитах. Ион МоО22+существует лишь в сильнокислых растворах, в которых одновременно могут сорбироваться и многие другие металлические ионы и где велика концентрация конкурирующего иона Н+. В этих условиях может вестись ионитная очистка молибденовых растворов от примесей тяжелых цветных, щелочных и других металлов. В сильнощелочной среде (рН = 8) молибден находится в форме неполимеризованного аниона МоО42-. Полная обменная емкость анионитов по молибдену в сильнощелочной среде ниже, чем при более низком рН, при котором молибден в растворе находится в виде полимеризованных, большого объема, ионов пара-, мета- и других полимолибдатов. Но большой объем этих ионов вносит пространственные затруднения в процесс сорбции: требуется, чтобы активные группы ионита были возможно менее экранированы другими элементами его структуры.
В слабокислой среде для сорбции молибдена из растворов эффективен сульфоуголь [20]. Захват им молибдена носит сорбционный характер, без обмена ионами. Активированный уголь также хорошо сорбирует молибден из бедных кислых растворов. Так, уголь марки КАУ (8, с. 415)для раствора, содержащего 0,144 г/л Мо и 0,1 моль/л H2SO4, показал динамическую обменную емкость (емкость до проскока – ДОЕ) 14 мг Мо на 1 г сорбента и полную обменную емкость (ПОЕ) 145 мг/г.
В технологии извлечения молибдена из растворов и их очистки используются и испытываются аниониты с разными основностью, структурой, пористостью. В слабокислой среде (рН 2 – 5) эффективно применение как сильноосновных, так и слабоосновных смол. В нейтральных и слабощелочных растворах обладают достаточной емкостью лишь сильноосновные смолы.
При 1,6 г/л Мо и рН раствора равном 3, сильноосновная смола АВ-16 показала ПОЕ-394 мг/г и коэффициент распределения по молибдену Kр=20615, а слабоосновной анионит АН-1 показал ПОЕ 233 мг/г и Kр= -3598. Но так как сильноосновные смолы прочнее удерживают молибден и для десорбции (элюирования или вымывания) из них требуются растворы более сильных щелочей (NaOH, КОН), а для вымывания со среднеосновной и тем более со слабоосновной смолы вполне достаточны 5 – 10%-ные растворы аммиака, то в практических условиях чаще находят применение средне- и слабоосновные аниониты. Применение раствора аммиака как элюента не вносит загрязнений щелочами и дает возможность получать более технологичные аммиачные соединения молибдена – поли - и парамолибдаты.
Для очистки аммиачно-молибденовых растворов от тяжелых металлов в полупромышленном масштабе использовали амфолиты. Амфолит – амфотерный сложный анионит, синтезированный из более простых анионитов с введением в них дополнительных органических групп. В результате получаются конденсированные продукты с крупной внутриструктурной и межструктурной пористостью и не полностью насыщенными связями. Разным соотношением реагентов при синтезе могут быть получены различные модификации амфолита, отличающиеся соотношением кислотных и основных групп.
Глава 4. Извлечение молибдена из отработанных руд методом экстракции
Степень извлечения молибдена из рудного сырья зависит не только от полноты химического вскрытия минерала и перевода молибдена в раствор, но и от полноты последующего извлечения его из растворов. В изложенных выше технологических схемах молибден извлекался из первичных растворов осаждением пара - и полимолибдата аммония, молибдата кальция, ферримолибдатов, а из бедных растворов и промывных вод – ионным обменом.
Сейчас наиболее экономичны и перспективны методы извлечения молибдена из растворов экстракцией и ионным обменом. Их достоинства:
1) полнота выделения полезного элемента из раствора;
2) селективность выделения элементов из комплексных растворов:
3) полнота отделения примесей;
4) простота аппаратурного оформления;
5) высокая производительность (причем производительность экстракции выше ионного обмена).
Извлечение молибдена из растворов и пульп экстракцией до настоящего времени находится на стадии укрупненных лабораторных и полупромышленных испытаний, показывающих в ряде случаев весьма перспективные результаты для промышленного использования [11, 13]. Этому способствует то, что молибден может находиться в растворах в разнообразных формах (катионы, анионы, полианионы, комплексные анионы). Молибденсодержащие ионы способны сольватироваться и давать комплексы со многими органическими соединениями. Поэтому возможна экстракция молибдена экстрагентами различных типов, анионо- и катионообменными, нейтральными. К первому типу экстрагентов относятся амины и четвертичные аммониевые основания, ко второму – алкилфосфорные кислоты, к третьему – спирты, кетоны, эфиры, в том числе трибутилфосфат.
Как показала практика [20], из анионообменных экстрагентов молибден достаточно успешно экстрагируется триоктиламином (сокращенно ТОА) (C8H17)3N и аммониевым основанием – диалкилметилбензиламмонийхлоридом [СН3—NR2—СН2С6Н5]Cl (так называемый дамбас). Молибден экстрагируется катионообменным экстрагентом Д2ЭГФК – ди-2-этилгексилфосфорной кислотой (С8Н17)2HPO4, экстрагентом нейтрального типа - трибутилфосфатом (C4H9)3PO4 (ТБФ), метилизобутилкетоном C5H12CO (МИБК), циклогексаноном (СН2)5СО и метилфенилкетоном (ацетофеноном) СН3СОС6Н5.
Указанные соединения отвечают требованиям, предъявляемым к экстрагентам: мало растворимы в воде, кипят при высоких температурах, большинство из них легче воды. Для понижения их вязкости, увеличения разности в плотности с водой и повышения температур воспламенения применяются они в виде растворов в керосине или других растворителях. Повышение температуры воспламенения особенно важно для применения циклогексанона и ацетофенона.
В табл. 2 дан предположительный состав экстрагируемых разными экстрагентами соединений
Таблица 2. Состав экстрагируемых веществ
| Кислотность исходного раствора | Экстрагент | Мольное отношение | Формула | |||
| pH | HCl, и. | [Mo] | экстрагент | Cl свя занный | ||
| 3,0 | - | ТОА | 1 | 2,3 | - | (R3NH)2MoO4 |
| 1,0 | - | » | 3 | 0,97 | - | (R3NH)2 [Mo6O14 (OH)10] |
| - | 10 | » | 1 | 1,0 | 3,1 | (R3NH)[MoO2Cl3] |
| 1,0 | - | Д2ЭГФК | 1 | 4,10 | - | MoO2 (R2PO4)2 ∙ 2HR3PO4 |
| - | 4 | ТБФ | 1 | 2,05 | 2,0 | MoO2Cl2 ∙ 2ТБФ |
| - | 6 | » | 1 | 2,0 | 2,9 | [H30 (H20) ∙ ТБФ [MoO2Cl3 ∙ (H20)] |
| - | 6 | МИБК | 1 | 3,0 | 3,0 | [H30 (H20) ∙ 3МИБК [MoO2Cl3 ∙ (H20)] |
С помощью экстракции можно решать ряд задач технологии молибдена:
а) повышение извлечения из бедных и сбросных растворов;
б) извлечение из растворов, получаемых при выщелачивании бедных руд и некондиционных концентратов;
в) отделение молибдена от вольфрама, что особенно важно в тех случаях, когда молибден находится в малом количестве по сравнению с близким ему по свойствам вольфрама.
Выводы
В результате выполнения данной работы можно сделать следующие выводы, которые позволят повысить выход молибдена из отработанных молибденовых руд и отходов производства, а также позволят использовать отходы молибденовой промышленности в народном хозяйстве:
Для получения особо чистого МоО3 необходимо использовать метод возгонки при высоких температурах, что позволит получить особо чистый МоО3, необходимый в металлургии и других отраслях промышленности
Для повышения выхода молибдена из отходов молибденовой промышленности можно использовать получение молибдена при помощи ионного обмена или экстракции органическими растворителями. Учитывая большой объем отходов можно предложить использовать ионный обмен, поскольку этот метод позволяет повторно использовать катиониты и аниониты и не требует сложной аппаратуры для улавливания паров органических растворителей.
Производительность метода экстракции для получения молибдена является большей, но требует строительства установок по поглощению паров органических растворителей и герметизации установок. Метод ионного обмена является технологически более простым, что будет предпочтительнее.
Отходы производства после выделения молибдена можно использовать в виде комплексных молибден содержащих удобрений в сельском хозяйстве, что позволит повысить урожайность зерновых.
Список использованной литературы
1. Ахметов Н.С. "Общая и неорганическая химия" М.: Высшая школа, 2001.
2. Берт Р.О. "Технология гравитационного обогащения" М.: Недра, 1990.
3. Бусев А. И. Аналитическая химия молибдена. М.: Издательство АН СССР, 1962, - 300с.
4. Васильев В. П. Аналитическая химия. В 2 кн. Кн. 2. Физико-химические методы анализа: Учеб. для студ. вузов, обучающихся по химико-технологическим специальностям – 2-е изд., перераб. и доп. - М.: Дрофа, 2002. - 384 с.
5. Глинка Н. Л. Общая химия. – Л.: Химия, 1988. – 702 с.
6. Гороновский И. Т., Назаренко Ю. П., Некряч Е. Ф. Краткий справочник по химии К.: Издательство АН СССР, 1962, 658 с.
7. Жарский И. М., Новиков И. Г. Физические методы исследования в неорганической химии. М.: Высшая школа, 1988, 271 с.
8. Зеликман А.Н., Коршунов Б.Г. Металлургия редких металлов М.:Металлургия, 1991.
9. Карякин Ю.В., Ангелов И.И. "Чистые химические вещества" М. 1974.
10. Крешков А. П., Ярославцев А. А. Курс аналитической химии. – М.: Химия, 1964. – 430 с.
11. Меркин Э.Н. "Экстракция металлов некоторыми органическими катионообменными реагентами" М., 1968.
12. Некрасов Б. В. "Основы общей химии" т.1 М.: Химия 1973.
13. Ритчи Г. М., Эшбрук А. В. Экстракция: принципы и применение в металлургии. Пер. с англ. М.: Металлургия, 1983.
14. Рысс М.А. "Производство ферросплавов" М.: Металлургия, 1985.
15. Скуг Д., Уэст Д. Основы аналитической химии. В 2 т. Пер с англ. М.: Мир, 1979, - 438 с.
16. Справочник химика. В 3-х т. М.: Химия, 1966, 1070 с.
17. Степин Б.Д., Горштейн И.Г., Блюм Г.З., Курдюмов Г.М., Оглоблина И.П. "Методы получения особо чистых неорганических веществ" Л.: Химия, 1969.
18. Фигуровский Н.А. "История химии" М.: Просвещение 1979.
19. Физическая химия. Практическое и теоретическое руководство. Под ред. Б. П. Никольского, Л.: Химия, 1987. – 875 с.
20. Химия и технология редких и рассеянных элементов. Под ред. Большакова К. А. Ч. ІІІ. М.: Высшая школа, 1976, 320 с.
21. Химия: Справочное издание/ под ред. В. Шретер, К.-Х, Лаутеншлегер, Х. Бибрак и др.: Пер. с нем. – М.: Химия, 1989.– 648 с.
22. Химическая энциклопедия в 5 т. / под ред. И. Л. Кнунянца. – М.: Советская энциклопедия, 1990.
23. Ягодин Г.А., Синегрибова О.А., Чекмарев А.М. "Технология редких металлов в атомной технике" М.: Атомиздат, 1974.
Похожие работы
... из отработанных катализаторов и химических остатков [16]. 3.3 Молибден из колошниковой пыли плавильных печей Этот процесс, разработанный X. Кастанья, предназначен для выделения молибдена в виде молибденовой кислоты из отходов, в частности, из отработанных катализаторов, содержащих носитель - у-оксид алюминия и молибден в виде оксида или сульфида. Процесс включает обработку отходов ...
... молибдена и др. Эти материалы могут быть использованы в качестве легирующие компоненты для выплавки легированных чугуну и стали. Результаты исследований [11] показали, что использование отработанных никелевых катализаторов позволяет получать заготовку шихты с содержанием никеля 11 % и ванадию 3 % при одношлаковом режиме плавки. 1.2 Особенности редкофазной обновительной плавки. Выполненный ...
... отходам производства. В докладе «О состоянии окружающей природной среды Российской Федерации в 1997 году» Государственного комитета Российской Федерации по охране окружающей среды отмечается, что на начало 1997 г. на предприятиях различных отраслей промышленности накоплено 1431,7 млн. т токсичных отходов. За 1997 г. на промышленных предприятиях РФ образовалось 89,4 млн т токсичных отходов, из ...
... . Заражение радиоактивными веществами и происходило ранее при воздушных и подводных испытаниях атомных бомб, а сейчас может произойти — при авариях атомных подводных лодок. Усиливается загрязнение природной среды твердыми промышленно-бытовыми отходами. Это вышедшие из употребления упаковочные материалы, бытовые и промышленные приборы, машины, бумага, консервные банки и, бутылки, остатки пищи, ...
0 комментариев