Навигация
Получение хлора и щелочи путем электролиза водных растворов хлоридов щелочных металлов. Извлечение ртути
ВВЕДЕНИЕ
Электролизеры для производства хлора и щелочи, в которых используется ртутная амальгама, находят широкое применение благодаря возможности получения концентрированных растворов щелочи. Однако в отходящих сточных водах таких электролизеров содержатся примеси ртути, что создает серьезные экологические проблемы.
Глава 1. ЭЛЕКТРОХИМИЧЕСКОЕ ПРОИЗВОДСТВО ХЛОРА, ЩЕЛОЧИ И ГИПОХЛОРАТА НАТРИЯ
Производство хлора и щелочи относится к числу крупнотоннажных электрохимических производств. Подавляющее количество хлора получают электрохимическим методом — электролизом водных растворов хлорида натрия.
Суммарная реакция, протекающая в электролизере, может быть выражена следующим уравнением:
2NaCl + 2H2O → Cl2 + 2NaOH + H2
Одновременно с хлором образуется соответствующее количество едкого натра (каустической соды) и водорода.
Основным потребителем хлора является промышленность органического синтеза. Хлор расходуется в производстве хлоридов тяжелых металлов, хлорной извести, для очистки воды. Второй продукт, получаемый одновременно с хлором — едкий натр — используется в целлюлозно-бумажной промышленности, в технологии искусственных волокон, в нефтехимической промышленности.
1.1 Теоретические основы электролиза растворов хлоридов
Получение хлора и щелочи основано на электролизе водных растворов хлоридов щелочных металлов двумя методами: с твердым катодом (диафрагменный) и с ртутным катодом.
На аноде во всех способах электрохимических производств хлора могут протекать две электрохимические реакции — выделение хлора и кислорода:
2Cl- - 2 →Cl2 (8.б)
2H2O — 4 → O2 + 4H+ (8.в)
Выход хлора по току определяется соотношением долей тока, расходуемых на выделение хлора и кислорода. По закону Фарадея при прохождении 1 А/ч электричества при электролизе выделится 1, 232 г хлора, 1,492г гидроксида натрия и 0,0376 г водорода. Вследствие протекания побочных электрохимических реакций на электродах и химических реакций в объеме раствора выход по току продуктов реакции всегда меньше 100%.
Обратимый потенциал разряда ионов хлора в растворе с содержанием 4,53 моль/л NaCl, при температуре 25°С равен 1,325 В; обратимый потенциал выделения кислорода в результате окисления молекул воды, рассчитанный по уравнению Нериста, при 25°С равен 1,23 В. Следовательно, хлор на аноде выделяется при электролизе водных растворов хлоридов за счет более высокого перенапряжения выделения кислорода.
На твердых катодах при электролизе растворов хлоридов щелочных металлов протекает реакция выделения водорода и образуется щелочь по реакции:
2Н2О + 2 → 2ОН- + Н2 (8.г)
С целью снижения перенапряжения на электролизере стремятся уменьшить потенциал выделения водорода. В качестве твердого электрода обычно используют сталь. Потенциал выделения водорода зависит от состояния поверхности катода, плотности тока, температуры и состава раствора.
Обратимый потенциал выделения водорода в растворе, содержащем хлорид натрия и едкий натр при соотношении, реально существующем в условиях электрохимического производства, составляет — 0,845В (отн. н.в.э). Перенапряжение водорода на стальном катоде при электролизе растворов хлорида с твердым катодом составляет 0,3В. Перспективным, вероятно, является снижение потенциала в результате деполяризации катода кислородом. При подаче к поверхности катода кислорода или воздуха протекает реакция:
О2 + 2Н2О + 4 → 4ОН- , (8.д)
которой соответствует потенциал, более положительный, чем потенциал выделения водорода. При использовании пористого графитового катода, подвергнутого предварительной гидрофобизации путем пропитки полимерным соединением, потенциал катода может быть снижен до 0,3 — 0,4В.
Суммарный процесс разложения хлорида натрия выражается следующим химическим уравнением:
2Н2О + 2 → Н2 + 2ОН-
2Cl- → Cl2 + 2
2H2O + 2Cl- → Cl2 + H2 + 2OH-
или 2H2O + 2NaCl → Cl2 + H2 + 2NaOH
Напряжение разложения в стандартных условиях для этой реакции составляет 2,17В и теоретический расход энергии на 1 т хлора 1640 кв/ч.
Выход по току зависит от степени совершенства разделения катодных и анодных продуктов и от растворимости хлора в анолите. Растворимость хлора в растворе хлорида натрия уменьшается с ростом температуры и концентрации NaCl. Следовательно, побочные реакции, в основе которых лежит растворенный хлор, будут уменьшаться с увеличением концентрации хлорида натрия и температуры.
1.2 Электролиз с твердым катодом и фильтрующей диафрагмой
В первых конструкциях промышленных электролизеров неподвижный электролит разделялся пористой диафрагмой на катодное и анодное пространство. Такая электрохимическая система не дает возможности осуществить производства хлора, каустической соды со стабильными выходами по току, т.к. в этом случае невозможно предотвратить диффузию и электроперенос гидроксильных ионов, накапливающихся в катодном пространстве, в анодное, что приводит к падению выхода по току.
Предотвращение этих потерь может быть обеспечено при электролизе с пористой диафрагмой и твердым катодом при осуществлении принципа противотока, т.е. непрерывной подачи электролита в анодное пространство и фильтрации его через диафрагму в катодное пространство навстречу гидроксид-ионам.
При этом направление движения электролита в порах диафрагмы будет противоположным направлению движения ионов ОН-, скорость подачи электролита в электролизер (скорость противотока) равна или больше скорости электролитического переноса и диффузии ионов гидроксила из катодного пространства
Условия электролиза. Аноды для хлорных электролизеров должны обладать высокой химической стойкостью. Этому требованию удовлетворяют магнетит, диоксид марганца, уголь, графит, платина.
В производстве хлора используются аноды из графита или окисно-рутениево-титановые аноды (ОРТА). До 70 -годов XX века графит служил основным материалом для изготовления анодов. Недостатком таких анодов является их значительный износ, составляющий 3,5 — 6,0 кг/т хлора, приводящий к возрастанию напряжения на электролизе из-за увеличения межэлектродного расстояния. Диоксид углерода, образующийся вследствие химического износа, загрязняет хлор. Срок службы графитовых анодов не превышает 12 — 14 мес.
В последние годы графитовые аноды вытесняются ОРТА — титановыми анодами, покрытыми слоем оксидов рутения и титана толщиной в несколько микрон. Износ таких анодов составляет 0,1 г/т хлора, что обеспечивает эксплуатацию в течение 4 — 6 лет.
В настоящее время практически все новые электрохимические производства хлора и щелочи по методу электролизера с твердым катодом и фильтрующей диафрагмой оснащены электролизерами с малоизнашивающимися металлическими анодами. Катоды для них изготавливают из малоуглеродистой стали.
Плотность тока зависит от природы материала анода, применяемого в хлорном производстве. При использовании графитовых анодов максимальная плотность тока составляет 1,0 — 1,5 кА/м2. Применение ОРТА позволяет повысить плотность тока до 2,5 — 3,0 кА/м2 без увеличения напряжения и расхода электроэнергии, т.е. интенсифицировать процесс в 2 раза.
Основным сырьем для производства хлора и каустической соды служит поваренная соль, в небольших масштабах используется также хлорид калия.
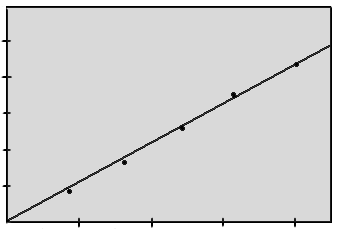
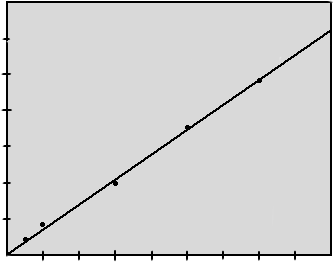
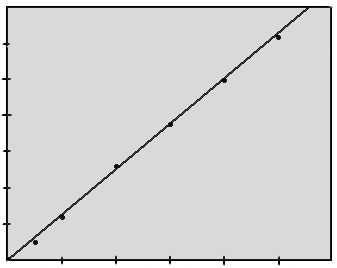
Состав раствора характеризуется начальной концентрацией исходного хлорида, рН анолита, концентрацией щелочи и хлорида в электролите. Зависимость выхода по току от концентрации едкого натра в электролитической щелочи представлена на рис. 8.2.
Величина рН прианодного слоя рассола определяет соотношение между выходами по току хлора и кислорода. Выход кислорода по току для ОРТА, представляющего практический интерес в качестве анода в производстве хлора, повышается при рН > 3,5. При понижении рН уменьшается износ графитовых анодов и падает растворимость хлора в анолите.
Примеси некоторых металлов, которые присутствуют в исходном электролите, влияют на процесс электролиза с фильтрующей диаграммой. В порах диафрагмы происходит взаимодействие растворимых солей кальция и магния со щелочью и карбонатами с образованием нерастворимых осадков.
Для очистки рассола от примесей кальция и магния при электролизе с диафрагмой применяют содово-каустический метод, основанный на образовании малорастворимых осадков СаСО3 и Мg(ОН)2.
В промышленных электролизерах разделение электродных пространств осуществляется с помощью фильтрующей диафрагмы. Диафрагма изготавливается из асбестового волокна, которое осаждается из пульпы, содержащей асбест хлорид натрия, и едкий натр, на катодную сетку.
В последнее время в производстве хлора широко применяют модифицированные полимерным веществом асбестовые осажденные диафрагмы, имеющие более длительный срок службы.
Соль растворяют в горячей воде и подают в нагреватель 2, где температура неочищенного рассола повышается до 50°С. Далее рассол поступает в аппарат непрерывной очистки — осветлитель 3.
Осветленный рассол собирается в баке 5, откуда подается на фильтры 6, где освобождается от механических примесей. Далее рассол поступает на нейтрализацию соляной кислотой в бак 7.
Рассол из напорного бака 9 подается в электролизер 10. Хлор, отводимый из электролизера при повышенной температуре, насыщен парами воды, и поступает на сушку, состоящую из двух стадий — охлаждение водой в колонне 11 и обработка серной кислотой в башне 12. После этого хлор поступает потребителю, либо на сжижение.
Глава 2. ЭЛЕКТРОЛИЗ С РТУТНЫМ КАТОДОМ
Хотя доля хлора, каустической соды и водорода, получаемая при электролизе с ртутным катодом за последнее время уменьшается, но она еще остается значительной.
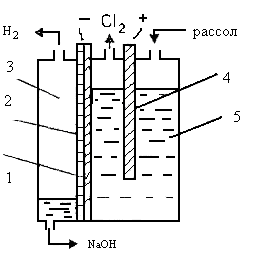
В способе с ртутным катодом процесс разделен на две стадии. В собственно электролизере идет получение хлора и амальгамы. Последняя из электролизера поступает в другой аппарат разлагатель, где разлагается водой. При этом образуется щелочь, водород и регенерируется ртуть (рис. 8.1б). Катодом в ванне является ртуть — на ней идет разряд ионов натрия, аноды графитовые. Диафрагма не требуется, так как в электролизере выделяется только один газ — хлор.
Анодный процесс в ваннах с ртутным катодом ничем не отличается от анодного процесса в ваннах с твердым катодом.
На ртутном катоде протекает иная электрохимическая реакция, чем при электролизе с твердым катодом. На ртутном катоде происходит разряд ионов натрия с образованием сплава натрия с ртутью — амальгамы:
Na+ + nHg + → NaHgn
К побочным процессам, протекающим на ртутном катоде, следует отнести выделение водорода и разложегние амальгамы с образованием щелочи и водорода. На ртутном катоде также возможно восстановление молекулярного хлора:
Cl2 + 2 → 2Cl-
Процесс разложения амальгамы является второй стадией производства хлора, щелочей по методу электролиза с ртутным катодом. Процесс разложения амальгамы проводят в отдельном аппарате, называемом разлагателем. Электрохимическая реакция протекает в короткозамкнутом гальваническом элементе, в котором амальгама является отрицательным электродом.
Условия электролиза. В промышленности используют электролизеры с горизонтальным расположением ртутного катода. Соответственно горизонтально располагаются и аноды. В качестве материала для изготовления анодов используется графит, а также применяются ОРТА. Износ графитовых анодов составляет 4 кг/т хлора. В результате износа расстояние между электродами увеличивается, что приводит к возрастанию напряжения на электролизере. Для предотвращения этого нежелательного явления имеется устройство для опускания графитовых анодов по мере их срабатывания. В современных электролизерах применяют групповое автоматизированное опускание анодов. Графитовые аноды постепенно вытесняются малоизнашиваемыми ОРТА.
Плотность тока. Электролиз с ртутным катодом происходит при более высоких электродных плотностях тока, чем электролиз с фильтрующей диафрагмой и с твердым катодом. Повысить плотность тока при электролизе с графитовыми электродами до 10 кА/м2 (1 А/см2) удается путем создания и совершенствования системы регулирования межэлектродного расстояния и перфорации анодов, обеспечивающей эффективное удаление пузырьков газа. Электролизеры, оснащенные ОРТА могут работать при плотностях тока до 14 — 15 кА/м2.
Состав раствора. Концентрация исходного хлорида натрия, поступающего на электролиз с ртутным катодом, не отличается от концентрации электролита, подаваемого в электролит с твердым катодом и фильтрующей диафрагмой. Однако коэффициент разложения хлорида при электролизе с ртутным катодом значительно ниже и не превышает 0,17. Это обусловлено зависимостью потенциала разряда ионов натрия и хлора от их активности в растворе.
Для уменьшения гидролиза хлора и снижения его содержания в растворе рН электролита должен быть не менее 3. Содержание примесей кальция может быть не более 1 г/л, магния — 0,005 г/л.
Температура. Повышение температуры при электролизе с ртутным катодом целесообразно, с точки зрения снижения напряжения на электролизере за счет уменьшения перенапряжения выделения хлора, а значит падения напряжения в электролите.
Однако с повышением температуры понижается перенапряжение выделения водорода и увеличивается скорость разложения амальгамы в электролизере. Поэтому при повышении температуры необходимо увеличивать и катодную плотность тока.
Похожие работы
... и щелочи служат, главным образом, растворы поваренной соли, получаемые растворением твердой соли, или же природные рассолы. Растворы поваренной соли независимо от пути их получения содержат примеси солей кальция и магния и до того, как они передаются в цеха электролиза, подвергаются очистке от этих солей. Очистка необходима потому, что в процессе электролиза могут образовываться плохо растворимые ...
... Показано, что галлий может быть полностью извлечен из золы-уноса ТЭЦ четырехкратной обработкой раствором щелочи концентрацией 200 г/л при t=80C и Т:Ж=1:10. Извлечение ванадия из золы-уноса ТЭЦ растворами кислоты и щелочи в исследованных условиях составляет 11-12%. Добавка NaCl при кислотном выщелачивании позволяет извлечь в раствор 79,8% железа и 24% галлия. ЛИТЕРАТУРА Дымов А.М., ...
... они брали ту самую "чистую" медь, почему соединили ее именно с оловом, а не с каким-нибудь другим металлом, в каких месторождениях встречается в природе медь, в каких именно химических соединениях, где эти месторождения расположены и насколько легко было древним людям ее вырабатывать и переплавлять? Очень странно, что кабинетные историки совершенно не утруждают себя подобными вопросами. А, ведь, ...
... а в анодное—ионы SO42- . Таким образом, раствор во всех его частях будет оставаться электронейтральным. Однако в катодном пространстве будет накапливаться щелочь, а в анодном—кислота. Схема электролиза раствора сульфата калия: 2K2SO4 Катод ← 4K+ 2SO42- → Анод 4K+ 2SO42- 4Н2О + 4е- =4ОН- + 4Н 2Н2О=4Н+ + 2О + 4e- KОН ...






0 комментариев