Навигация
Перспективы развития хлорной промышленности
2.1 Перспективы развития хлорной промышленности
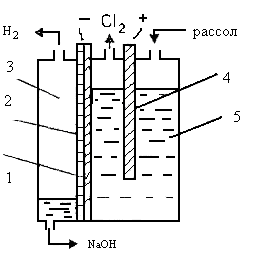
До начала 70-х годов около 60% хлора и каустической соды производили электролизом с ртутным катодом, 40% - электролизом с твердым катодом и фильтрующей мембраной. По первому методу получают чистую каустическую соду, не содержащую хлоридов. Однако в связи с тем, что ртуть неизбежно попадает в окружающую среду, в ряде стран электролиз с ртутным катодом интенсивно сокращается. Перспективен метод электролиза с ионообменной мембраной, позволяющий получать щелочь, не отличающуюся по качеству от продукта, образующегося при разложении электролитической амальгамы натрия.
Особенностью современного этапа развития хлорной промышленности является широкое применение металлических анодов. Современные электролизеры оснащены ОРТА. В связи с заменой графитовых анодов на последние усиливается тенденция к повышению электродных плотностей тока до 2 — 3 кА/м2 в диафрагменных электролизерах и до 10 — 14 кА/м2 (1 — 1,4 А/см2) — в электролитах с ртутным катодом. Освоены в промышленности фильтр-прессные биполярные электролизеры большой мощности.
2.2 Электросинтез гипохлорита натрия
Гипохлорит натрия (NaOCl) является достаточно сильным окислителем и находит применение при очистке от примесей сточных вод, а также как эффективное антисептическое средство. Гипохлорит натрия получают электролизом водного раствора хлорида натрия без диафрагмы. Суммарная реакция образования гипохлорита натрия в электролизере может быть записана следующим образом:
NaCl + H2O → NaOCl + H2 (8.и)
Побочными электрохимическими реакциями являются:
на аноде 48OCl- + 24H2O → 16ClO3- + 32Cl- + 3O2 + 48H+ + 48 на катоде OCl- + H2O + 2 → Cl- + 2OH-
Условия электролиза. В производстве гипохлорита натрия используют различные материалы для изготовления анодов — графит, магнетит, титан с осажденной на поверхность платиной, ОРТА. Наибольший интерес в настоящее время представляют ОРТА.
Выход гипохлорита по току зависит от потенциала ОРТА. Максимальный выход по току (98,0%) достигается при потенциале анода 1,6 В (отн. нас. каломельного электрода).
Плотность тока зависит от материала анода. При использовании графитовых анодов электролиз можно провести при плотностях тока до 1,4 кА/м2. На платино-титановых анодах выход гипохлорита натрия по току практически не изменяется до достижения плотности тока 4 кА/м2 (0,4 А/см2). Оптимальной плотностью тока при электролизе с ОРТА является 1,5 — 2 кА/м2 (0,15 — 0,2 А/см2). При повышении анодных плотностей тока выход по току гипохлорита натрия несколько снижается, а хлората натрия - возрастает.
Для практического использования пригодны разбавленные растворы гипохлорита, применять концентрированные исходные растворы хлорида натрия экономически нецелесообразно. Обычно элеткролизу подвергают растворы, содержащие 50 — 100 г/л NaCl, а в некоторых случаях — морскую воду.
Оптимальное значение рН раствора
В отходах действующих российских предприятий по производству хлора и каустика, складированных на свалках и в шламохранилищах, содержится до 1200 т ртути. В отвалах и шламохранилищах, расположенных в районе производств хлора и каустика, выведенных из эксплуатации (в основном во 2-й половине 1990-х гг.), содержится до 1300 т ртути. В почвогрунтах в окрестностях закрытых и действующих отечественных предприятий по производству хлора и каустика количество аккумулированной ртути (в результате ее технологических потерь) оценивает более чем в 4000 т; несколько сотен тонн ртути накоплено в донных отложениях водных объектов, расположенных в зонах влияния некоторых из указанных предприятий. По оценкам, в отходах Новосибирского завода химконцентратов, размещенных на свалках и в шламохранилищах, количество ртути составляет от 100 до 500 т. В окрестностях данного предприятия следует ожидать очень высокий уровень загрязнения почвогрунтов ртутью. Судя по всему, все выше приводимые оценки являются минимальными. Например, есть сведения, что в Иркутской области в почвах промышленных предприятий, производящих хлор и каустик, аккумулировано более 1000 т ртути и еще более 2000 т металла находится в шламонакопителях.
Безусловно, во всех отраслях отечественной промышленности, где использовалась или используется ртуть (включая предприятия оборонной промышленности), требуется организация ее максимально полного рециклинга. Это определяет необходимость внедрения строгой статистической отчетности о наличии и(или) потреблении (балансе потребления) металлической ртути, о ее распределении в ходе технологических процессов, о накопленных и вновь образующихся ртутьсодержащих отходах и их утилизации. Следует нормативно запретить вывоз на полигоны (на временное захоронение) и тем более на свалки всех видов ртутьсодержащих отходов; они должны в обязательном порядке перерабатываться и обезвреживаться с получением вторичной ртути.
Особое внимание должно быть уделено организации системы сбора и последующей утилизации широко используемых в промышленности и быту ртутьсодержащих приборов и изделий (ртутных термометров, ртутных ламп и т. д.). В частности, в России в 1998-2002 г. ежегодно использовалось (разбивалось и т. д.) до 9 млн. ртутных термометров, содержащих порядка 18 т металлической ртути [59]. Из этого количества примерно 1 т ртути в той или иной мере утилизировалась (с получением вторичной ртути), а остальная ртуть – 17 т – в конечном счете оказывалась на свалках отходов и в канализационной сети (что характерно для городов и крупных поселков), в почве (особенно в сельской местности), т. е. потенциально способна рассеиваться в окружающей среде, поступая в атмосферу, поверхностные водные системы, грунтовые воды и т. д. В обозримом будущем ртутные термометры будут по-прежнему широко применяться в России в качестве основных средств измерения температуры в самых различных сферах человеческой деятельности и, таким образом, являться существенным источником эмиссии в окружающую среду токсичной ртути. По оценкам, общая масса ртути, присутствующая в эксплуатируемых в настоящее время в России промышленных и медицинских термометрах, составляет не менее 238 т, причем в последние годы на внутренний рынок страны ежегодно поступают ртутные термометры, содержащие порядка 15-16 т ртути (при этом существенная часть металлической ртути, используемой при производстве отечественных термометров, импортируется). Значительное количество ртути (десятки, если не сотни тонн) присутствуют во многих других ртутных и ртутьсодержащих приборах, устройства и изделиях, которые в той или иной мере эффективно (при соблюдении определенных правил) эксплуатируются в различных организациях и на предприятиях страны.
Необходимо отметить, что так называемая ступпа (с содержанием ртути до 50-80%) – продукт переработки ртутьсодержащих изделий и приборов (в основном ртутных ламп), образующаяся на электроламповых заводах и многочисленных демеркуризационных предприятиях страны, насколько известно, практически никогда не поступала на дальнейшую переработку на специализированные предприятия (в частности, в ЗАО «НПП «Кубаньцветмет») с целью получения вторичной ртути. В лучшем случае встречается информация, что ртутная ступпа якобы хранится в специальных емкостях (контейнерах) на станциях (предприятиях) демеркуризации или размещается на свалках-полигонах (в так называемых бункерах временного хранения). Если это действительно так, то к настоящему времени количество ртути в накопленной ступпе составляет – в масштабах страны – около 25 т.
Потенциальными источниками ртути являются предприятия, перерабатывающие и(или) сжигающие каменный уголь (коксохимические заводы, ТЭЦ и т. д.), а также доменное производство и цементная промышленность. Например, в коксохимическое производство страны в 2001-2004 гг. ежегодно (в составе углей) поступало до 3,2-3,4 т ртути, из которых очистными установками улавливалось не более 0,5 т, а около 1,3 т металла выбрасывалось в атмосферу с отходящими газами. В углях, которые ежегодно сжигаются на отечественных предприятиях по выработке электроэнергии и тепла, содержится порядка 15-17 т ртути, из которых 11-13 т эмитирует в атмосферу. Ежегодная эмиссия ртути в атмосферу при производстве доменного чугуна в России в 2001-2004 гг. оценивается в 1,7-1,8 т, при производстве цемента – в 3,1-3,3 т. Определенное количество металла улавливается пылегазоочистными установками. Безусловно, совершенствование систем очистки пылегазовыбросов на указанных промышленных предприятиях позволит не только существенно снизить техногенную эмиссию данного опасного поллютанта в окружающую среду, но и (при утилизации продуктов улавливания) получать вторичную ртуть (до 20-25 т ежегодно).
Глава 3. ИЗВЛЕЧЕНИЕ РТУТИ ИЗ РАСТВОРОВ ПРОИЗВОДСТВА ХЛОРА И ЩЕЛОЧИ
Похожие работы
... и щелочи служат, главным образом, растворы поваренной соли, получаемые растворением твердой соли, или же природные рассолы. Растворы поваренной соли независимо от пути их получения содержат примеси солей кальция и магния и до того, как они передаются в цеха электролиза, подвергаются очистке от этих солей. Очистка необходима потому, что в процессе электролиза могут образовываться плохо растворимые ...
... Показано, что галлий может быть полностью извлечен из золы-уноса ТЭЦ четырехкратной обработкой раствором щелочи концентрацией 200 г/л при t=80C и Т:Ж=1:10. Извлечение ванадия из золы-уноса ТЭЦ растворами кислоты и щелочи в исследованных условиях составляет 11-12%. Добавка NaCl при кислотном выщелачивании позволяет извлечь в раствор 79,8% железа и 24% галлия. ЛИТЕРАТУРА Дымов А.М., ...
... они брали ту самую "чистую" медь, почему соединили ее именно с оловом, а не с каким-нибудь другим металлом, в каких месторождениях встречается в природе медь, в каких именно химических соединениях, где эти месторождения расположены и насколько легко было древним людям ее вырабатывать и переплавлять? Очень странно, что кабинетные историки совершенно не утруждают себя подобными вопросами. А, ведь, ...
... а в анодное—ионы SO42- . Таким образом, раствор во всех его частях будет оставаться электронейтральным. Однако в катодном пространстве будет накапливаться щелочь, а в анодном—кислота. Схема электролиза раствора сульфата калия: 2K2SO4 Катод ← 4K+ 2SO42- → Анод 4K+ 2SO42- 4Н2О + 4е- =4ОН- + 4Н 2Н2О=4Н+ + 2О + 4e- KОН ...






0 комментариев