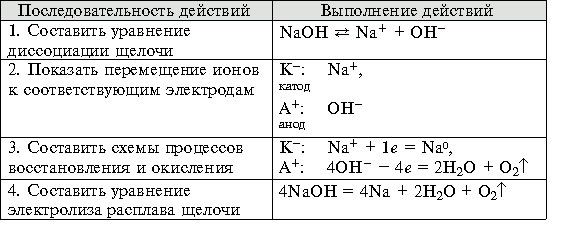
Навигация
2 моль
1) ![]() (КОН) – массовая доля щелочи в растворе после реакции электролиза, которая зависит от содержания гидроксида калия в исходном растворе (она не изменяется в ходе электролиза) и массы воды, которая подверглась электролизу.
(КОН) – массовая доля щелочи в растворе после реакции электролиза, которая зависит от содержания гидроксида калия в исходном растворе (она не изменяется в ходе электролиза) и массы воды, которая подверглась электролизу.
![]() (КОН) =
(КОН) = ![]()
2) mконечн. р-раКОН = mисход. р-раКОН – m1(H2O)
3) m1(H2O) = ![]() 1(H2O) M(H2O)
1(H2O) M(H2O)
![]() ;
; ![]()
m1(H2O) = 4моль 18 г/моль = 72г
4) mисход. р-раКОН = V р-раКОН ![]() = 300мл 1,2г/мл = 360г
= 300мл 1,2г/мл = 360г
5) mисход. (КОН) = ![]() (КОН) mисход. р-раКОН = 0,224 360мл = 80,64г
(КОН) mисход. р-раКОН = 0,224 360мл = 80,64г
6) ![]() (КОН)
(КОН) ![]()
Ответ: после электролиза ![]() (КОН) = 0,28 (28%)
(КОН) = 0,28 (28%)
Задача №6
При электролизе 16г. расплава некоторого соединения
водорода с одновалентным элементом на аноде выделился водород количеством вещества 1 моль.
Установите формулу вещества, взятого для электролиза.
Решение
I I
m(Эл Н)=16г
(H2) = 1моль
Эл Н - ?
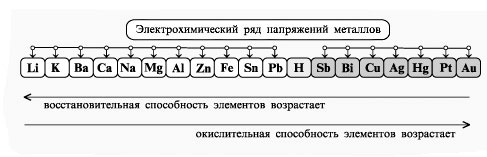
По условию, водород выделяется на аноде, значит, его ионы имеют отрицательный заряд, а искомый элемент имеет положительный заряд. Ясно, что ЭЛН – гидрид.
расплав
![]() 2 2 1 Эл+ +1
2 2 1 Эл+ +1![]()
![]() Эл0
Эл0![]()
![]() 2 2 2H– - 2
2 2 2H– - 2![]()
![]() Н20
Н20![]()
![]() 2Эл+ + 2Н – 2Эл0 + Н20
2Эл+ + 2Н – 2Эл0 + Н20
![]() Эл Н= Эл1++Н 1–
Эл Н= Эл1++Н 1–
на катоде : Эл1+
![]() на аноде : H 1–
на аноде : H 1–
m=16г ί ![]() =1моль
=1моль
2ЭлН = 2Эл↓ + Н2↑
расплав 1 моль
2 моль
1) Mr(ЭлН) = (х + 1) а.е.м
2) ![]()
3) ![]()
![]()
4) ![]()
5) х+1=8
х =7, Аr(Эл)=7, значит Эл – лимит
Ответ: ЭлН – LiH, гидрид лития
Задача № 7
Электролиз 400мл. 6%-ного раствора сульфата меди (II) (плотность 1,02г/мл) продолжали до тех пор, пока масса раствора не уменьшилась на 10г. Определите массовые доли соединений в оставшемся растворе и массы продуктов, выделившихся на инертных электродах.
Решение
Vр-ра CuSO4= 400мл
![]() = 6%
= 6%
![]() = 1,02 г/мл
= 1,02 г/мл
∆mр-ра = 10г
н.у.
![]() ?
?
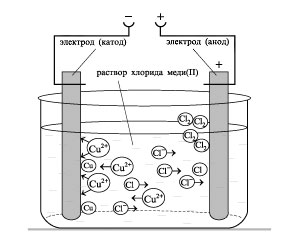
См. схему реакции электролиза и электронные полуреакции в задаче №4, часть VII
![]() = 1,02 г/мл
= 1,02 г/мл
Vр-ра=400мл
![]() Ñmр-ра = 10г
Ñmр-ра = 10г ![]()
ί m - ? m - ? ![]()
2CuSO4 + 2H2O = 2Сu↓ + O2↑ + 2H2 SO4 (1)
раствор М=64г/моль М=32г/моль М=98 г/моль
М=160 г/моль Vm=22,4 л/моль
Похожие работы
... пособие по прикладной химии «Задачи по теоретическим основам химической технологии», составленное по материалам представленной работы. 3. Методика решения задач по теоретическим основам химической технологии Одна из главных задач химической науки и промышленности - получение необходимых человеку веществ (продуктов, материалов). Поэтому большинство учебных химических задач снизано с ...
... . - Формирование навыков техники выполнения эксперимента, умения решать расчетные и качественные задачи, составлять уравнения химических реакций, протекающих при электролизе растворов и расплавов электролитов.- Воспитание самостоятельности, организованности, формирование умения работать в группе, развитие творческих способностей, логического мышления, внимания, памяти. Оборудование: компьютер, ...
... его с кислородом или воздухом). Глава 3. Методические разработки по "Водород. Кислоты. Соли" Цели урока: Обучающие: создать условия для обобщения и систематизации знаний учащихся по теме: «Водород. Кислоты. Соли», продолжить формировать умение классифицировать неорганические вещества; закрепить основные понятия «оксиды», «кислоты», «соли», «индикатор»; уметь выделять главное. Развивающие: ...
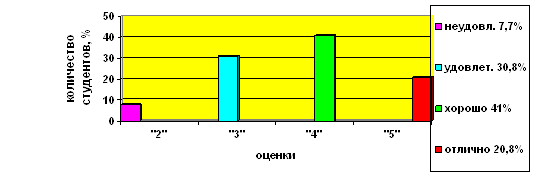
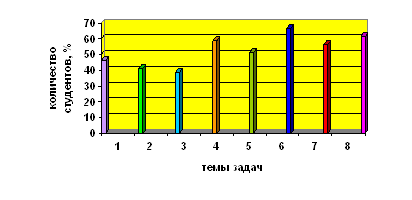
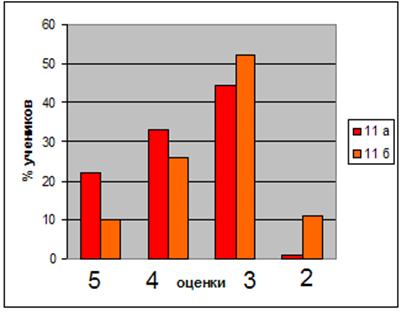
... учащихся Диаграмма 2. Динамика успеваемости и качества обучения Таким образом, можно сделать вывод, что предложенная в работе гипотеза, что разработка и реализация новых методических подходов к изучению темы «Бериллий» позволят заметно повысить уровень знаний, научной культуры, уверенности в своих способностях школьников нашла свое подтверждение в результате наших исследований. ЛИТЕРАТУРА ...




0 комментариев